题目内容
【题目】小明同学利用一瓶敞口放置已久的NaOH溶液进行了一些实验探究。
【提出问题】这瓶NaOH溶液变质程度如何呢?
【提出猜想】小明的猜想:NaOH溶液部分变质。
【实验探究】小明设计如下实验来验证自己的猜想,请根据表中内容填写小明实验时的现象:
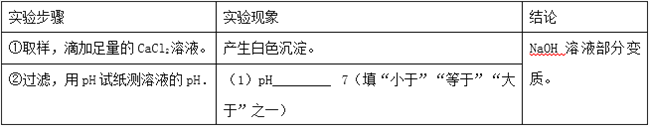
⑴pH_____7。
【深入研究】通过实际实验,确认这瓶放置已久的NaOH溶液部分变质。现从该瓶中取了100g 溶液,向其中逐滴加入稀盐酸,至恰好不再产生气泡时共消耗稀盐酸73g,同时产生CO2气体2.2g,此时测得溶液的pH=7。
(2)恰好反应时所得溶液的质量是_____g。
(3)求这瓶溶液中Na2CO3的质量分数_____。( 写出计算过程)
【答案】 > 170.8 5.3%
【解析】(1)由结论可知,用足量的氯化钙溶液除去了部分变质后生成的碳酸钠,故溶液中仍有没有变质的氢氧化钠,故溶液的pH大于7;
(2)根据质量守恒定律,反应前各物质的总质量为173g,反应后有2.2g的二氧化碳气体跑掉,其他的物质全部在溶液中,故恰好反应时所得溶液的质量是173g-2.2g=170.8g;
(3)设变质后溶液中碳酸钠的质量为x
Na2CO3+2HCl=2NaCl+CO2![]() +H2O
+H2O
106 44
x 2.2g
![]() =
=![]()
x=5.3g
这瓶溶液中Na2CO3的质量分数为; ![]()
答;这瓶溶液中Na2CO3的质量分数为5.3%。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目