题目内容
【题目】将暗紫色的固体A加热,产生一种无色无味的气体B;取淡黄色粉末C放入B中点燃,发出明亮蓝紫色火焰,生成一种有刺激性气味的气体D;取金属E放入B中点燃,剧烈燃烧,火星四射,生成一种黑色固体F,试回答:
(1)写出有关的反应的符号表达式,在后面的括号写出该反应所属的基本反应类型:
①加热A生成B:____________________(____________________)
②C与B反应生成D:_________________(____________________)
③E与B反应生成F:__________________(____________________)
(2)E与B的反应中,集气瓶内预先要装少量水,其目的是_____,若实验过程中未看到剧烈燃烧,火星四射的现象,可能是什么原因造成的_______(写一条原因即可)。
【答案】 KMnO4![]() K2MnO4+MnO2+O2 分解反应 S+O2
K2MnO4+MnO2+O2 分解反应 S+O2![]() SO2 化合反应 Fe+O2
SO2 化合反应 Fe+O2![]() Fe3O4 化合反应 防止高温熔化物炸裂集气瓶 铁丝未打磨(或集气瓶中氧气浓度低或温度未达铁丝着火点等)
Fe3O4 化合反应 防止高温熔化物炸裂集气瓶 铁丝未打磨(或集气瓶中氧气浓度低或温度未达铁丝着火点等)
【解析】本题是推断题,解题时往往需要从题目中挖出一些明显或隐含的条件,抓住突破口(突破口往往是现象特征、反应特征等),获得结论,最后把结论代入原题中验证。
高锰酸钾是暗紫色的固体,受热分解生成锰酸钾、二氧化锰和氧气,硫是淡黄色粉末,在氧气中燃烧发出明亮的蓝紫色火焰,生成有刺激性气味的气体二氧化硫;铁在氧气中燃烧时火星四射、放热、生成四氧化三铁,因此A~F分别是高锰酸钾、氧气、硫、二氧化硫、铁和四氧化三铁。综上所述:
①加热高锰酸钾生成氧气的符号表达式为:KMnO4![]() K2MnO4+MnO2+O2该反应是一种物质生成三种物质,属于分解反应;
K2MnO4+MnO2+O2该反应是一种物质生成三种物质,属于分解反应;
②硫在氧气中燃烧生成二氧化硫的符号表达式为:S + O2 ![]() SO2 ,该反应是由两种物质生成一种物质,属于化合反应;
SO2 ,该反应是由两种物质生成一种物质,属于化合反应;
③铁在氧气中燃烧生成四氧化三铁的符号表达式为:Fe + O2 ![]() Fe3O4,该反应是由两种物质生成一种物质,属于化合反应;
Fe3O4,该反应是由两种物质生成一种物质,属于化合反应;
(2)铁燃烧的反应中,集气瓶内预先要装少量水,其目的是防止铁燃烧形成的高温熔融物溅落炸裂集气瓶;若实验过程中未看到剧烈燃烧,火星四射的现象,可能是铁丝未打磨(或集气瓶中氧气浓度低或温度未达铁丝着火点等)。

【题目】下图是水分子分解的示意图,请从宏观、微观两个方面写出由右图所获得的信息。

⑴___________________ ⑵______________
⑶__________________ ⑷_________________
【答案】 化学变化中,分子可以再分,原子不能再分 化学反应的本质是分子的分裂,原子的重新结合 分子是有原子构成的 原子是化学变化中的最小粒子
【解析】(1)由微观示意图可知,在化学变化的过程中,分子可以再分,而原子不能再分;
(2)由微观示意图可知,在变化过程中,分子分裂为原子,原子重组为新分子;
(3)由微观示意图可知,原子是化学变化中最小的微粒;
(4)有图可知,分子是由一种构成的;
【题型】简答题
【结束】
15
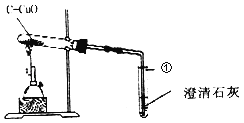
【题目】下图是实验室常用的实验仪器与装置,根据所学知识回答下列问题:

(1)请写出有编号的仪器名称①________②_________
(2)在实验室里,通常用下列方法制氧气:①双氧水和二氧化锰混合;②氯酸钾和二氧化锰混合加热;③加热高锰酸钾;其中最能体现“节能、环保、低碳”理念的制备方法是_______(填序号),写出该反应的文字表达式:____________。
(3)当用B和D装置制取氧气时,发现水槽中的水变成紫红色,为避免此现象发生,应对该实验装置作出的一点改动是__________________。 若用D装置收集氧气,实验结束时,应先从水槽中移出导气管,再熄灭酒精灯,原因是____________。
(4)收集一瓶氧气后,用带火星的木条深入瓶中未见木条复燃,其原因可能是_________(写一条)
(5)阅读以下资料并回答:
物质 | 制取气体的药品 | 反应条件 | 气体的物理性质 |
氨气 | 氢氧化钙固体、 氯化铵固体 | 需要加热 | 密度比空气小、 易溶于水 |
制取氨气_____(填“可以”或“不可以”,下同)采用B装置,收集氨气_____采用C装置
【题目】小明设计了如下图所示的实验装置来证明氧化铜能加快过氧化氢溶液的分解,并与相同条件下MnO2的催化效果做比较,实验时间均以生成30mL气体为准(即比较反应速率)。用图示装置测量产生气体的体积,其它可能影响实验因素均已忽略,相关数据如下:
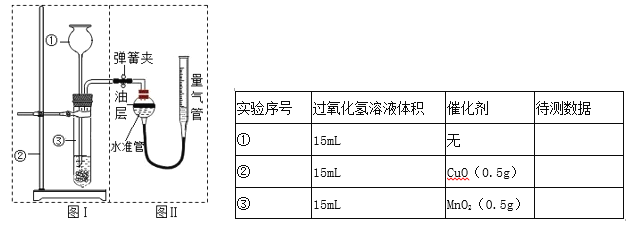
(1)检查图(I)装置气密性的方法是:_______________;
(2)检查图(Ⅱ)装置气密性的方法是:_______________;
(3)图(Ⅱ)装置中油层的作用是________。
(4)从设计原理看,实验中的“待测数据”可以是指______。
(5)如果要进一步探究CuO是否是该反应的催化剂,请完成下列实验。
实验步骤和现象 | 设计这一步骤的目的 |
(1)取15mL过氧化氢溶液,加入0.5g CuO后,产生O2的速率比未加入时快得多 | CuO能加快过氧化氢溶液的分解 |
(2)___________ | _________ |
(3)___________ | _____ |