题目内容
(5分)硫酸铜溶液对过氧化氢(H2O2)的分解有催化作用。取8.5%的过氧化氢溶液40 g倒入小烧杯中,向其中加入15%的硫酸铜溶液6.6 g,使过氧化氢完全分解。
计算:(1)过氧化氢溶液中溶质的质量为______g。
(2)产生氧气的质量(写出计算过程)。
(3)反应后所得硫酸铜溶液中溶质的质量分数(写出计算过程)。
(1)3.4;(2)[解]设过氧化氢完全分解生成氧气的质量为x。
2H2O2CuSO42H2O + O2↑
68 32
3.4 g x 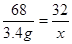 x=1.6g
x=1.6g
答:略。
(3)硫酸铜的质量:6.6 g × 15% =0. 99 g
所得溶液的质量:40 g + 6.6 g -1.6 g=45 g
所得硫酸铜溶液中溶质的质量分数=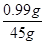 ×100% =2.2%
×100% =2.2%
答:略。
解析试题分析:(1)已知过氧化氢溶液的质量和溶质质量分数,即可求得其溶质质量;(2)利用化学方程式和过氧化氢的质量即可求得生成氧气的质量;(3)利用原硫酸铜溶液的质量和其溶质质量分数即可求得硫酸铜的质量,依据质量守恒定律可以求得放出氧气后的溶液质量,利用溶质质量分数的计算公式即可作答。
考点:溶质质量分数的计算;质量守恒定律;化学方程式的计算

练习册系列答案
相关题目
某不纯的铁5.6g与足量的稀硫酸充分反应,生成0.21g氢气,则铁中混有的金属可能是( )
| A.Zn | B.Cu | C.Mg | D.Ag |
小英同学为了测定某地区石灰石样品中碳酸钙的质量分数,取该样品15g,现将75mL的稀盐酸分三次加入石灰石样品中,每次充分反应后测得生成气体的质量,实验数据如下表:
| 实验 | 第一次 | 第二次 | 第三次 |
| 加入稀盐酸的量/mL | 25 | 25 | 25 |
| 生成气体的质量/g | 2.2 | m | 1.1 |
(1)m的值是 g.
(2)求该样品中碳酸钙的质量分数(保留一位小数).
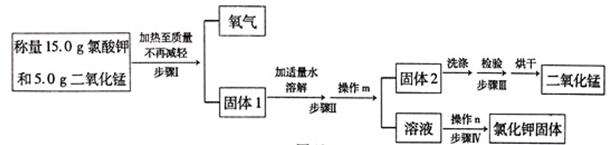
 2KCl+3O2↑),并回收提纯氯化钾和二氧化锰。
2KCl+3O2↑),并回收提纯氯化钾和二氧化锰。