题目内容
(1)如图信息,瓶中溶液长期放置后溶质质量分数变小,是因为该物质具有 _性。(1分)
(2)某探究小组的同学对某工业废水(含有H2SO4、HNO3)中H2SO4的含量进行测定.取50g废水于烧杯中,加入足量BaCl2溶液、过滤、洗涤、干燥,得BaSO4固体11.65g.请解答下列问题:
①计算50g废水中H2SO4的溶质质量分数。(3分,要求写出计算过程)
②若改用KOH溶液(利用消耗的KOH的质量)测定50g废水中H2SO4
的含量,结果可能会 ____(选填“偏低”、“偏高”或“不变”),原因是_____________________________________。(每空1分,计2分)
解析试题分析:(1)由于该瓶中的硫酸溶质质量分数标注的是98%,属于浓硫酸,而浓硫酸具有吸水性,所以瓶中溶液长期放置后浓度变稀;由于溶液的体积与其密度乘积即为溶液的质量,而溶液的质量与其溶质质量分数的乘积即为溶质的质量求出溶液中的溶质,所以则量筒内溶液的溶质质量为ρg/ml×50ml×98%;
(2)①解:设废水中含硫酸的质量为x
H2SO4+BaCl2=BaSO4↓+2HCl
98 233
x 11.65g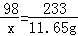
x="4.9g"
所以废水中H2SO4的溶质质量分数为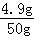 ×100%=9.8%
×100%=9.8%
答:(略)
②偏高 ; 废水中含有硝酸,硝酸也会消耗氢氧化钾
考点:有关溶液的溶质质量分数的计算;有关化学方程式的计算

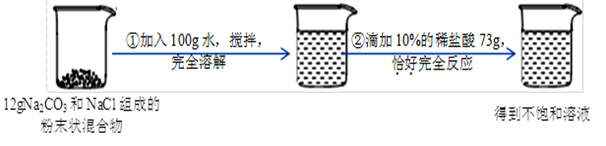
现有生石灰和碳酸钙的固体混合物9.5g,将其高温煅烧一段时间后,剩余固体8.4g,向剩余固体中加入150g溶质质量分数为7.3%的稀盐酸至恰好不再产生气泡为止,所得溶液恰好为中性,则原固体混合物中钙元素的质量分数约为( )
| A.50% | B.63.2% | C.84.5% | D.40% |
某化学兴趣小组为了测定镁铜合金中镁的质量分数,取出3g合金样品,将60g稀硫酸分6次加入样品中,充分反应后过滤、洗涤、干燥、称重,得到的实验数据如下:
| 稀硫酸用量 | 剩余固体质量 | 稀硫酸用量 | 剩余固体质量 |
| 第一次加入10g | mg | 第四次加入10g | 1.0g |
| 第二次加入10g | 2.0g | 第五次加入10g | 0.6g |
| 第三次加入10g | 1.5g | 第六次加入10g | 0.6g |
(2)第六次实验后,所得溶液中硫酸镁的质量分数(要求写出计算过程,结果保留到0.1%)