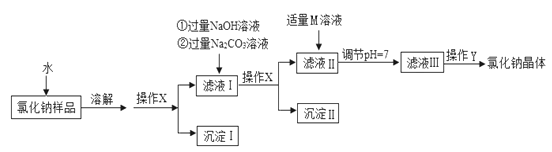
题目内容
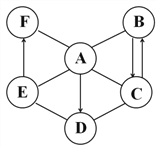
【题目】下图为某些物质间的转化关系。A为常见化肥,E常作食品干燥剂,M只含3种元素。部分反应条件和生成物已略去。
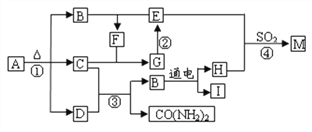
(1)化学式:A___________,F____________。
(2)反应①提醒在施用A时要注意__________。
(3)反应②的化学方程式:_______________。
(4)反应③中C和D的质量比为_________________。
(5)反应④符合“化学反应绿色化”(即原料中所有的原子全部转入期望的产品中),写出反应④的化学方程式________________。
【答案】 NH4HCO3 或(NH4)2CO3 Ca(OH)2 避免气温高的时候施用 CaCO3 ![]() CaO+CO2↑ 22∶17 2CaO+ 2SO2 +O2= 2CaSO4
CaO+CO2↑ 22∶17 2CaO+ 2SO2 +O2= 2CaSO4
【解析】分析:A为常见化肥,加热条件下分解生成三种物质,说明A为碳酸氢铵,分解生成二氧化碳、水、氨气;氨气和二氧化碳一定条件下反应可生成尿素和水,所以B为水,E常作食品干燥剂,E为氧化钙;水和氧化钙生成氢氧化钙,氢氧化钙和二氧化碳反应生成碳酸钙沉淀和水,碳酸钙高温条件下分解生成氧化钙和二氧化碳,所以C为二氧化碳,D为氨气;F是氢氧化钙,;水在通电条件下分解生成氢气和氧气,氧气、二氧化硫,氧化钙一定条件下反应生成硫酸钙。(1)化学式:A NH4HCO3,F Ca(OH)2;(2)碳酸氢铵在施用A时要注意不能与碱性物质混合使用,不能在烈日或高温下施用;(3)碳酸钙高温下分解的方程式为CaCO3 ![]() CaO+CO2↑ (4)二氧化碳和氨气反应的方程式为:2NH3+CO2== CO(NH2)2+H2O,由方程式可知二氧化碳和氨气的质量比为22∶17;(5)反应④符合“化学反应绿色化”(即原料中所有的原子全部转入期望的产品中),即反应为化合反应,反应④的化学方程式2CaO+ 2SO2 +O2= 2CaSO4。
CaO+CO2↑ (4)二氧化碳和氨气反应的方程式为:2NH3+CO2== CO(NH2)2+H2O,由方程式可知二氧化碳和氨气的质量比为22∶17;(5)反应④符合“化学反应绿色化”(即原料中所有的原子全部转入期望的产品中),即反应为化合反应,反应④的化学方程式2CaO+ 2SO2 +O2= 2CaSO4。

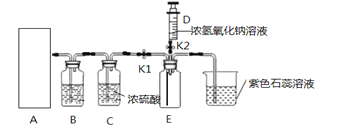
【题目】如图是小忻同学设计的一套实验室制备纯净、干燥的CO2和验证CO2能与NaOH反应的装置。
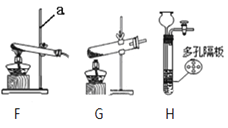
(1)写出仪器a的名称:______________。
(2)在实验室中,为制得二氧化碳,应选择装置______填在A处。
(3)为获得纯净的二氧化碳,装置B中应放_____,装置C中浓硫酸的作用是___________。
a.NaOH溶液 b.澄清石灰水 c.饱和的NaHCO3溶液 d.浓硫酸
(4)当装置E中收集满CO2时,关闭止水夹K1,打开止水夹K2,把注射器D中5mL浓NaOH溶液压入装置E中,发生反应的化学方程式为_______________,观察到的现象是______________。小平同学认为要证明CO2与NaOH确实反应,还应把注射器NaOH溶液换成等体积的_______,再做一次实验。
(5)小红认为,我们还可以采用检验生成物的方法,确认CO2与NaOH反应了。于是,小玲同学取少量E中溶液于烧杯中,再向溶液中滴加几滴稀盐酸,未发现有气泡产生。据此现象小玲认为CO2与NaOH没有反应。你认为该结论是否正确,并说明理由。__________________。
(6)为了进一步得出结论,几位同学结合所学知识分工合作,集思广益,设计了下列实验进行验证。请将下表补充完整。
实验步骤 | 实验现象 |
①取E中溶液,滴加过量CaCl2溶液 | _____________________________ |
②对①进行过滤,向滤液中滴加_________ | 溶液变红 |
【结论】CO2与NaOH能反应,且反应后的溶液中还有NaOH。
【反思评价】
(1)在实验步骤①中为什么要加入过量的CaCl2溶液?_____________________________。
(2)小玲同学认为在实验步骤①中可以用Ca(OH)2 溶液代替CaCl2证明这一瓶中是否含有NaOH,你认为呢?并说明理由______________________________________________。
【题目】醋酸钙和硫酸钠的溶解度表及溶解度曲线如下。下列说法正确的是
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度 S/g | 醋酸钙 | 36.0 | 34.7 | 33.8 | 33.2 | 33.0 | 32.7 |
硫酸钠 | 9.6 | 20.2 | 40.8 | 48.4 | 47.5 | 47.0 | |
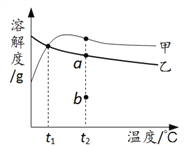
A. 甲为硫酸钠
B. t1℃应介于10℃~20℃
C. t2℃时乙溶液由b点转化到a点可恒温蒸发水或加入乙
D. 甲、乙的饱和溶液从t1℃升温到t2℃,溶质的质量分数都变小