题目内容
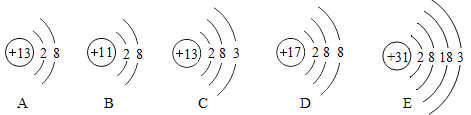
【题目】根据如图所示粒子的结构示意图回答问题:
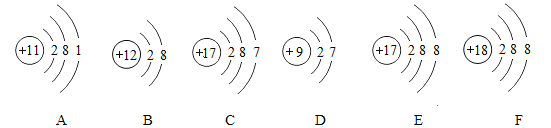
(1)具有相对稳定结构的微粒是_______(填序号,下同)
(2)在化学反应中易得到电子的微粒是 ______;
(3)表示阳离子的微粒是________;
(4)化学性质相似的原子是 __________
(5)A和C具有相同的是________(填序号)。
①质子数 ②电子数 ③电子层数 ④最外层电子数
【答案】B、E、F C、D B C、D ③
【解析】
(1)若粒子的最外层电子数为8,则属于相对稳定结构,图中B、E、F的最外层电子数均为8,均属于相对稳定结构。
(2)C、D的最外层电子数均是7,大于4,在化学反应中易得到1个电子。
(3)B质子数=12,核外电子数=10,质子数>核外电子数,为阳离子;
(4)决定元素化学性质的是原子的最外层电子数,C和D粒子的最外层电子数均为7,最外层电子数相同,化学性质相似。
(5)A和C的电子层数都是3层。
故答案为:(1)B、E、F;(2)C、D;(3)B(4)C、D;(5)③。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案【题目】依据溶解度知识回答下列小题。
下表为NaOH、Na2CO3、NaCl、Ca(OH) 2分别在水中的溶解度(g)
t/°C | NaOH | Na2CO3 | NaCl | Ca(OH)2 |
10 | 51 | 12. 2 | 35. 8 | 0. 17 |
10℃时,向4只盛有100 g水的烧杯中分别加入40 g上述四种物质配成溶液,依据上表回答下列小题。
【1】上述溶液为不饱和溶液的是
A. Ca(OH) 2 溶液B. Na2CO3 溶液C. NaCl 溶液D. NaOH 溶液
【2】上述溶液中,溶质质量分数最大的是
A. Na2CO3 溶液B. NaOH 溶液C. NaCl 溶液D. Ca(OH) 2 溶液
【3】关于上述形成的Na2CO3溶液,下列说法正确的是
A. 溶质的质量为40 g
B. 溶液的质量为140 g
C. 该烧杯底部有未溶解的固体
D. 10℃时,100 gNa2CO3溶液里含有12.2 g碳酸钠
【4】下图为氯化钠、碳酸钠在水中的溶解度曲线。依据图像判断,下列说法正确的是

A. 碳酸钠的溶解度小于氯化钠的溶解度
B. 20℃时,氯化钠溶液的质量分数一定小于碳酸钠溶液
C. 30℃时,两种物质的饱和溶液中溶质质量相等
D. 将Na2CO3和NaCl均达到饱和的混合溶液,从40℃降温至20℃时,析出的固体物质主要是Na2CO3
【题目】现有25g石灰石样品,请按下面要求计算
(1)25g样品与足量的稀盐酸反应放出8.8gCO2(杂质不溶于酸,且不与酸反应),请计算该样品的纯度(CaCO3的质量分数)是多少?_____
(2)若将25g样品平均分成两份,分别加工成块状和粉末状,将两份样品分别放入锥形瓶中,同时加入相同体积,相同浓度的足量稀盐酸充分反应,请在图象上画出块状样品与稀盐酸反应放出CO2的曲线示意图。_____
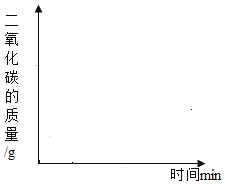
(3)若将一定质量的该石灰石样品高温煅烧,有关物质质量反应时间的变化如表所示:
时间/min | t1 | t2 | t3 | t4 | t5 |
CO2质量/g | 2.2 | 4.4 | 6.6 | 8.8 | 8.8 |
剩余固体质量/g | 22.8 | 20.6 | m | 16.2 | 16.2 |
则m=_____,t3时剩余固体中除杂质外含有的物质是_____(填化学式)