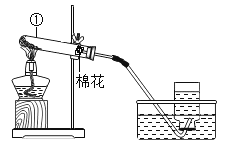
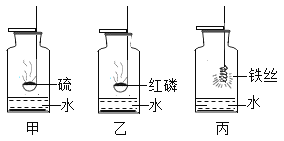
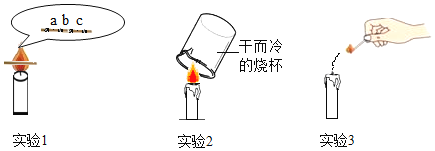
题目内容
【题目】用下图所示实验验证质量守恒定律。
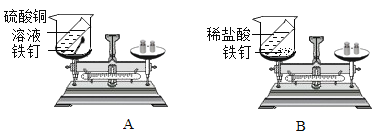
(1)甲同学设计的实验如图A所示,将铁钉浸到硫酸铜溶液中,当观察到______时,进行第二次称量,指针位置保持不变。
(2) 乙同学设计的实验如图B所示,反应后托盘天平的指针______ (选填“向左”、“向右”或“不”)偏转。
(3)两位同学通过交流反思得到启示:在探究化学反应前后物质的总质量是否发生改变时,对于有气体参加或有气体生成的反应一定要在______装置中进行。
(4) 从微观角度分析质量守恒的原因是______ (填序号)。
A 原子种类不变 B 分子种类不变
C 原子质量、数目不变 D 分子质量、数目不变
【答案】铁钉表面附着一层红色固体 向右 密封 AC
【解析】
(1)甲同学设计的实验如图A所示,将铁钉浸到硫酸铜溶液中,当观察到铁钉表面附着一层红色固体时,说明铁和硫酸铜反应生成了硫酸亚铁和铜,进行第二次称量,指针位置保持不变。
故填:铁钉表面附着一层红色固体。
(2)乙同学设计的实验如图B所示,反应后铁和稀盐酸反应生成的氢气逸出装置,导致托盘天平的指针向右偏转。
故填:向右。
(3)两位同学通过交流反思得到启示:在探究化学反应前后物质的总质量是否发表改变时,对于有气体参加或有气体生成的反应一定要在密封装置中进行。
故填:密封。
(4)从微观角度分析质量守恒的原因是原子种类不变,原子质量、数目不变。
故填:AC。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案【题目】除去物质中的少量杂质,下列实验方法能达到实验目的是( )
实验目的 | 实验方法 | |
A | 除去铜粉中混有的少量碳粉 | 在空气中充分灼烧 |
B | 除去 | 加入过量的铁粉、过滤 |
C | 除去氯化钾中的少量氯酸钾 | 加入少量二氧化锰,并加热 |
D | 除去 | 将气体通过足量灼热的氧化铜 |
A. AB. BC. CD. D
【题目】依据溶解度知识回答下列小题。
下表为NaOH、Na2CO3、NaCl、Ca(OH) 2分别在水中的溶解度(g)
t/°C | NaOH | Na2CO3 | NaCl | Ca(OH)2 |
10 | 51 | 12. 2 | 35. 8 | 0. 17 |
10℃时,向4只盛有100 g水的烧杯中分别加入40 g上述四种物质配成溶液,依据上表回答下列小题。
【1】上述溶液为不饱和溶液的是
A. Ca(OH) 2 溶液B. Na2CO3 溶液C. NaCl 溶液D. NaOH 溶液
【2】上述溶液中,溶质质量分数最大的是
A. Na2CO3 溶液B. NaOH 溶液C. NaCl 溶液D. Ca(OH) 2 溶液
【3】关于上述形成的Na2CO3溶液,下列说法正确的是
A. 溶质的质量为40 g
B. 溶液的质量为140 g
C. 该烧杯底部有未溶解的固体
D. 10℃时,100 gNa2CO3溶液里含有12.2 g碳酸钠
【4】下图为氯化钠、碳酸钠在水中的溶解度曲线。依据图像判断,下列说法正确的是

A. 碳酸钠的溶解度小于氯化钠的溶解度
B. 20℃时,氯化钠溶液的质量分数一定小于碳酸钠溶液
C. 30℃时,两种物质的饱和溶液中溶质质量相等
D. 将Na2CO3和NaCl均达到饱和的混合溶液,从40℃降温至20℃时,析出的固体物质主要是Na2CO3
【题目】下表中的四个观点都是错误的。请你仿照表中示例各找出一个化学方程式来否定相应的错误观点。
错误观点 | 否定例证(化学方程式) |
示例:氧化反应一定是化合反应 | CH4+2O2 |
(1)化合反应的反应物都是单质 | _____ |
(2)分解反应的生成物都是单质 | _____ |
(3)有单质和化合物生成的反应都是置换反应 | _____ |
(4)反应物和生成物都是化合物的反应肯定是复分解反应 | _____ |
【题目】现有25g石灰石样品,请按下面要求计算
(1)25g样品与足量的稀盐酸反应放出8.8gCO2(杂质不溶于酸,且不与酸反应),请计算该样品的纯度(CaCO3的质量分数)是多少?_____
(2)若将25g样品平均分成两份,分别加工成块状和粉末状,将两份样品分别放入锥形瓶中,同时加入相同体积,相同浓度的足量稀盐酸充分反应,请在图象上画出块状样品与稀盐酸反应放出CO2的曲线示意图。_____
(3)若将一定质量的该石灰石样品高温煅烧,有关物质质量反应时间的变化如表所示:
时间/min | t1 | t2 | t3 | t4 | t5 |
CO2质量/g | 2.2 | 4.4 | 6.6 | 8.8 | 8.8 |
剩余固体质量/g | 22.8 | 20.6 | m | 16.2 | 16.2 |
则m=_____,t3时剩余固体中除杂质外含有的物质是_____(填化学式)