题目内容
【题目】12.5g碳酸钙和氧化钙粉未组成的均匀混合物中含碳酸钙80%,向其中加入10%的稀盐酸至恰好完全反应。
(1)混合物中碳酸钙的质量。
(2)反应后所得溶液中溶质的质量分数。(计算结果精确到0.1%)
【答案】(1)10g (2)14.1%
【解析】
(1)碳酸钙的质量=混合物的质量×80%=12.5g×80%=10g;
混合物中氧化钙的质量为12.5g-10g=2.5g;
(2)设碳酸钙与稀盐酸反应生成CaCl2的质量为x,消耗HCl的质量为y,产生CO2的质量为z
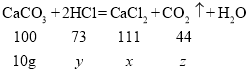
![]() x=11.1g
x=11.1g
![]() y=7.3g
y=7.3g
![]() z=4.4g
z=4.4g
设氧化钙与稀盐酸反应生成氯化钙的质量为m,消耗稀盐酸的质量为n

![]() m≈4.96g
m≈4.96g
![]() n≈3.26g
n≈3.26g
加入稀盐酸溶液的质量为:![]() ;
;
反应后所得溶液中溶质的质量分数为:![]() 。
。
答:混合物中碳酸钙的质量为10g;
反应后所得溶液中溶质的质量分数为14.1%。

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目