题目内容
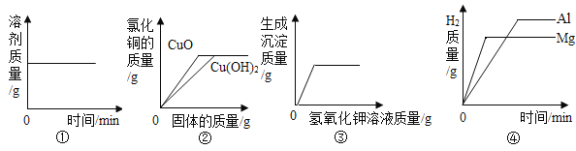
【题目】设计对比实验、控制变量是学习化学的重要方法,下列对比实验能达到目的的是( )
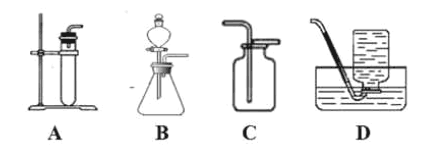
A.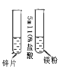 证明镁的活动性比锌强
证明镁的活动性比锌强
B.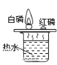 探究氧气是燃烧的条件之一
探究氧气是燃烧的条件之一
C.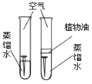 探究铁生锈的条件
探究铁生锈的条件
D.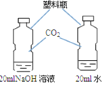 探究二氧化碳与氢氧化钠溶液能否发生反应
探究二氧化碳与氢氧化钠溶液能否发生反应
【答案】D
【解析】
A、证明镁的活动性比锌强,除了盐酸的用量和浓度相同外,还应控制金属颗粒的大小,选项中锌是片状,镁是粉末状,金属的表面积不同,故A错误;
B、烧杯上端白磷燃烧、红磷不燃烧,说明达到可燃物的着火点是燃烧的条件之一,故B错误;
C、左边试管中铁钉与水、氧气同时接触,右边试管中铁钉只与水接触,一段时间后,左边铁钉生锈,右边铁钉不生锈,只能说明铁钉生锈与氧气有关,不能说明与水有关,故C错误;
D、盛有相同体积氢氧化钠溶液的塑料瓶变瘪程度更大,说明二氧化碳能够与氢氧化钠反应,故D正确。
故选D。

【题目】某同学查阅资料得知,实验室常用电石(主要成分是CaC2)与水反应制取乙炔(C2H2),反应的化学方程式为CaC2 +2H2O==Ca(OH) 2 +C2H2↑(电石中的杂质不溶于水且不与水反应,也不与Na2CO3溶液反应)。在实验室中,该同学把一定量的CaC2加入Na2CO3溶液中充分反应后过滤,得到滤渣和滤液,并对滤液的成分进行探究。
[提出问题]滤液中溶质的成分是什么?
[猜想与假设]
猜想一:NaOH
猜想二:NaOH、Na2CO3
猜想三:NaOH、Ca(OH) 2
[实验验证]
实验序号 | 实验操作 | 实验现象 | 实验结论 |
实验一 | 取少量滤液于试管中,向其中加入过量稀盐酸 | 无气泡产生 | 猜想________不成立 |
实验二 | 取少量滤液于试管中,向其中滴加适量碳酸钠溶液 | _________ | 猜想三成立,发生反应的化学方程式为_______ |
[拓展延伸]
(1)若向CuCl2溶液中加入少量CaC2充分反应,可观察到有气泡产生,且_______。
(2)实验室保存电石应注意__________________________。