��Ŀ����
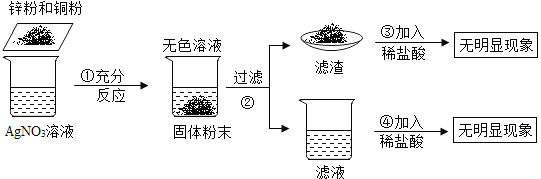
����Ŀ��ij��ɫ�������Ҫ�ɷ�ΪNaCl�����ܺ���MgCl2��KCl��BaCl2��NaOH�е�һ�ֻ������ʣ�Ϊ�����ɫ����ijɷֲ���ȥ�������ʣ���������ʵ�飺
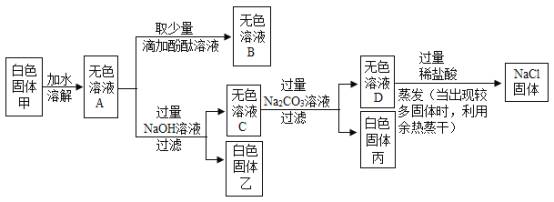
��1��д�����ɰ�ɫ������Ļ�ѧ����ʽ_________________��
��2������ɫ��ҺD�м������ϡ�����Ŀ����__________________��
��3����������ʵ���֪����ɫ�������һ��û�е�������______________________��
��4��ȡ��Һ��ɫ��ҺA��B��C��D��һ�֣��ֱ�μӵ�ϡ�����NaOH��Һ��Ʒ�У����ܰѶ�������������ɫ��Һ________________��
���𰸡�![]() ȥ���������������ƺ�̼���ơ� �������ơ��Ȼ��� BCD
ȥ���������������ƺ�̼���ơ� �������ơ��Ȼ��� BCD
��������
��ɫ�����ˮ֮�õ���ɫ��ҺA��˵��˵�����в���ͬʱ�����Ȼ�þ���������ƣ�������Ϊ�Ȼ�þ���������Ʒ�Ӧ����������þ�������Ȼ��ƣ����Ȼ�þ���������Ʋ��ܹ��棬�õ���ɫ��ҺB��˵����Һ���Լ��ԣ�˵�����в������������ƣ���ɫ��������������þ��˵�����л����Ȼ�þ����ɫ�������̼��ӣ�˵�����к����Ȼ����������õ��Ȼ��ƹ��壬˵�����в������Ȼ��أ���˼��к����Ȼ��ơ��Ȼ�þ���Ȼ������������������ƺ��Ȼ��ء�
�������Ϸ�����֪����1���Ȼ������Ժ�̼��������̼�ᱵ�������Ȼ��ƣ���ѧ����ʽΪ��![]() ,���
,���![]() ��
��
��2����ɫ��ҺD�к��й������������ƺ�̼���ƣ�ϡ������Ժ���������̼���Ʒ�Ӧ�����Ȼ��ƺ�ˮ���������ϡ�����Ŀ����ȥ���������������ƺ�̼���ƣ����ȥ���������������ƺ�̼���ơ�
��3����ɫ�������һ��û�е��������������ơ��Ȼ��أ�
��4����ɫ�������һ�������Ȼ�þ���Ȼ������Ȼ���һ���������������ƣ����ܺ����Ȼ��أ��ʼ�ˮ֮����ɫ��ҺA��һ�������Ȼ�þ���Ȼ������Ȼ��ƣ��ӷ�̪֮��õ���ɫ��ҺB����B����һ�������Ȼ�þ���Ȼ������Ȼ��ơ���̪���������ƿ���ȥ���Ȼ�þ����������þ�������Ȼ��ƣ������������������Һ�����ɫ��ҺC������ɫ��ҺC��һ�������������ơ��Ȼ������Ȼ��ƣ�̼���ƿ���ȥ���Ȼ������������̼������Һ�����ɫ��ҺD����D��һ�������������ơ�̼���ơ��Ȼ��ƣ�
A������ɫ��ҺA�μӵ�����������Һ�У��Ȼ�þ���Ժ������������ɰ�ɫ����������þ���Ȼ��ƣ�����ɫ��ҺA�μ�ϡ������Һ���Ȼ�������ϡ�������ɰ�ɫ�������ᱵ�����ᣬ���ܲ���������������ͬ�����֣����������⣻
B��B�к���̪������������������ҺB���죬�μ�����B����죬���Լ���ϡ�����NaOH��Һ������Ҫ��
C��C�к����������ơ��Ȼ������Ȼ��ƣ��μ�ϡ���ᣬ�Ȼ�������ϡ�������ɰ�ɫ�������ᱵ�����ᣬ�μ���������������C���Լ���ϡ�����NaOH��Һ������Ҫ��
D��D�����������ơ�̼���ơ��Ȼ��ƣ��μ�ϡ����̼���ƿ��Ժ�ϡ�������������ƶ�����̼��ˮ���������ɣ��μ���������������D���Լ���ϡ�����NaOH��Һ������Ҫ��
��ѡ��BCD��