��Ŀ����
����Ŀ���Ȼ������ճ�����ı���Ʒ��Ҳ����Ҫ�Ļ���ԭ�ϡ�
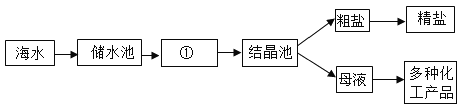
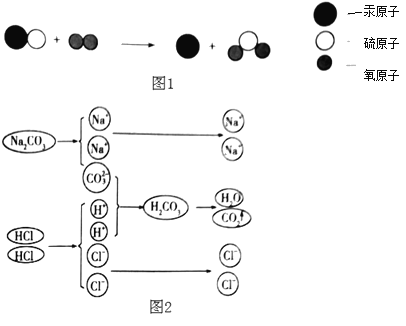
��1����ͼ�����ú�ˮ��ȡ���εĹ��̣���ͼ�Т���_____�أ������������ȴ������
��2�����ν��о��ƣ���������ͼ��ʾ�����γ��� NaCl �⣬���������� MgCl2��CaCl2��Na2SO4 �Լ���ɳ�����ʡ�ijͬѧ���ô�����Ʒ�����ᴿ��
�ṩ���Լ���ABaCl2 ��Һ��BNa2CO3 ��Һ��CK2CO3 ��Һ��DNaOH ��Һ��
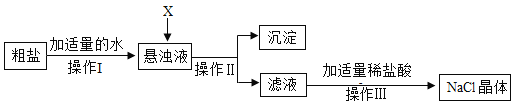
������ȥ����Һ�е� MgCl2��CaCl2��Na2SO4�����ṩ���Լ���ѡ�� X ���������Լ������μ�˳������Ϊ��������_____������ţ���
�ڲ������������_____���˲���ʹ�ò�������������_____��ͨ���˲����� ������Һ�г����� NaCl �⣬�����е�������_____���ѧʽ����
�ۼ�������������У�������Ӧ�Ļ�ѧ����ʽΪ_____�����кͷ�Ӧ����
���𰸡����� DAB��ADB ���� ���� NaOH��Na2CO3 Na2CO3+2HCl�T2NaCl+H2O+CO2��
��������
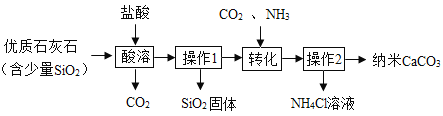
��1���Ȼ��Ƶ��ܽ�����¶ȵ�Ӱ��仯����ˮɹ�ε�ԭ������������ͷ��������ã�ʹˮ�����������Ȼ�����ҺԽ��ԽŨ����ˮ������һ���̶�ʱ���γ��Ȼ��Ƶı�����Һ���ټ�������ʱ���ͻ����Ȼ��ƾ�����������ͼ�Т��������أ�
��2��������ȥ����ҺI�е�MgCl2��CaCl2��Na2SO4�����μ�˳������Ϊ������������������Һ���������ƺ��Ȼ�þ��Ӧ����������þ�������Ȼ��ƣ���ȥ�Ȼ�þ�����Ȼ�����Һ�������ƺ��Ȼ�����Ӧ�������ᱵ�������Ȼ��ƣ���ȥ�����ƣ���̼������Һ��̼�������Ȼ��Ʒ�Ӧ����̼��Ƴ������Ȼ��ƣ���ȥ�Ȼ��ƣ�̼�������Ȼ�����Ӧ����̼�ᱵ�������Ȼ��ƣ���ȥ�ϲ�����Ĺ������Ȼ������������Ȼ�����Һ������������Һ�ĵμ�˳����Ե����������ΪDAB��ADB��
�ڲ���������Һ���룬�����������ǹ��ˣ��˲���ʹ�ò�������������������ͨ���˲����� ������Һ�г�ͨ���������õ�����Һ���������Ȼ��ơ��������������ƺ�̼���ơ�
��3��������ϡ���ᣬϡ����������������Ʒ�Ӧ�����Ȼ��ơ�ˮ����ȥ�������ƣ��÷�ӦΪ�кͷ�Ӧ��ϡ��������̼���Ʒ�Ӧ�����Ȼ��ơ�ˮ��������̼����ȥ̼���ơ���Ӧ����ʽΪ��Na2CO3+2HCl�T2NaCl+H2O+CO2������Ӧ��Ϊ�κ��ᣬ�������кͷ�Ӧ��

����Ŀ����ѧ�о�С���ڿ�չ��������������ȡ�����ķ�Ӧ�ж������̵�������֮���ֽ�������Ѱ���µĴ�������̽��ʵ�顣
��������� 1��Ѱ�����������ܷ����ڹ���������Һ�ֽ�Ĵ�������֤�ݣ�����ܣ� ���Ĵ�Ч����Σ�
��ʵ����� 1��
ʵ �� | �� �� |
�ֱ���ȡ 5 ���� 5%�Ĺ���������Һ�� A��B ��֧�Թ��У��� A �м��� a ����������ĩ�����ֱ��� A��B ��֧�Թ�����������ǵ�ľ�����۲����� | A �Թ��в������ݣ������ǵ�ľ����ȼ��B �Թ������������� |
����ʵ������� A �Թܵ�ʣ�����ʷ��룬�����ù������ϴ�ӡ�������� | ���ù�������Ϊ a �� |
����ʵ������õ��Ĺ������ʢ�� 5 ���� 5%�Ĺ���������Һ���Թ��У����Թ�����������ǵ�ľ�� | ������ð���������ǵ�ľ����ȼ |
�����ֱ���ȡ 5 ���� 5%�Ĺ���������Һ���� C��D �� ֧�Թ��У��� C �Թ��м��� a ����������ĩ���� D �Թ��м��� a �˶������̷�ĩ |
��ʵ����ۣ�
��1��A �����������_____��
��2����������������������ֽ�Ĵ�����Ѱ�Ҹý��۵�֤����Ҫ�������ʵ��_____��ѡ������������������չ���ġ�
��ʵ�����ۣ�
��1�����ʵ������Ŀ����_____��
��2�����������з��������жϣ��Ӷ��ﵽʵ���������Ŀ�ġ�a�������жϣ��۲� C��D��֧�Թ��в������ݵĿ�����b�������жϣ�_____��
��������Ϣ����������ֽ�����ö������̻���������ͭ��������Ϊ����
��������� 2������ͭ����ɫ��ĩ���Ƿ�Ҳ��������طֽ�Ĵ��������Ƿ�ȶ�������Ч�����ã�
��ʵ����� 2��ijͬѧ�����ɵ����������Ϊ�����������������ʵ�飨��������Ӱ��ʵ������ؾ����ԣ���
ʵ����� | ��������� | ������������ | �������� |
�� | 1.2 �� | X | |
�� | 1.2 �� | ����ͭ 0.5 �� | Y |
�� | m | �������� 0.5 �� | Z |
��1��д��������ڶ������̵Ĵ������·����ķ�Ӧ�Ļ�ѧ����ʽ��_____��
��2������ʵ��Ӧ��������������������ָ_____������ѧ�����Ƕȣ�X��Y��Z ����ֵ�ϵĴ�С��ϵ��_____��
��3����ʵ��ڱ�ʵ��ٵ���������������_____������������С��������ȷ��������˵������ͭ�ܼӿ�����صķֽ����ʡ�������m������ֵӦ��Ϊ_____��
��4����ʵ��ڷ�Ӧ��Ĺ��徭�����ˡ�ϴ�ӡ����ﴦ�������õ� 0.5 �˺�ɫ��ĩ�� �ٽ���ɫ��ĩ����_____��������������
���ܽ���ߣ�������̼��������𣬵��������п�ȼ��ʧ�����ö�����̼������