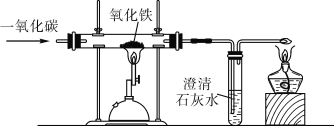
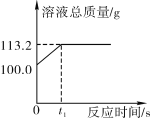
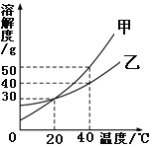
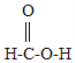题目内容
【题目】分别用不同量的锌加入到一定量的Cu(NO3)2、AgNO3、Al(NO3)3混合溶液中,充分反应后过滤。以下是不同情况下对滤渣或滤液成分的探究
(1)往滤液中加入盐酸,若无明显现象,请分析滤液中溶质的成分______。
(2)往滤渣中加入盐酸,若无气体放出,则滤渣中可能含有什么金属______?
(3)若过滤后的滤液为无色,试分析反应前后溶液质量的变化情况______。
【答案】一定含有Al(NO3)3、Zn(NO3)2,可能含有Cu(NO3)2 Cu 锌与硝酸银反应使溶液质量减少,与硝酸铜反应时使溶液质量增加,当减少的质量与增加的质量相等时,溶液的质量可能不变;当减少的质量大于增加的质量时,溶液的质量可能减少;当减少的质量小于增加的质量时,溶液的质量可能增加
【解析】

在金属活动性顺序中,铝>锌>氢>铜>银,故锌不能与Al(NO3)3溶液反应;锌先与硝酸银反应生成银和硝酸锌,当硝酸银完全反应会,锌再与硝酸铜反应生成铜和硝酸锌。
(1)若向所得滤液上滴盐酸无明显现象,说明一定不含硝酸银,因为银离子和氯离子不共存会形成白色沉淀氯化银;滤液中一定含有没有反应的Al(NO3)3、反应生成的Zn(NO3)2,可能含有Cu(NO3)2;
(2)若向所得滤渣上滴盐酸无气泡产生,说明滤渣中一定不含锌,一定有银、可能有铜,
(3)若过滤后的滤液为无色,说明滤液中不含铜离子,说明滤液中一定只含有没有反应的Al(NO3)3、反应生成的Zn(NO3)2,因为铜、银、锌的相对原子质量为64、127、65,且该反应为置换反应,锌与硝酸银反应使溶液质量减少,与硝酸铜反应时使溶液质量增加,当减少的质量与增加的质量相等时,溶液的质量可能不变;当减少的质量大于增加的质量时,溶液的质量可能减少;当减少的质量小于增加的质量时,溶液的质量可能增加。

 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案【题目】写出下列反应的化学方程式,并按要求回答问题:
化学反应 | 有关的化学方程式 | 简答 |
铁丝在氧气中燃烧 | _____ | 反应中铁元素从_____态变成_____态 |
镁带燃烧 | _____ | 反应物物质的量之比为_____ |
硫粉在氧气中燃烧 | _____ | 集气瓶内预先放少量水的目的是_____ |