题目内容
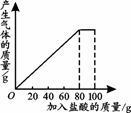
(3分)某校课外小组同学用含有泥沙和氯化钠杂质的碳酸钠样品进行了如下实验:向一只60 g的烧杯中加入35 g样品,然后分5次加入盐酸,每次加入盐酸40 g(不考虑水、氯化氢逸出),每次反应完全后,称量烧杯和烧杯内物质的总质量。记录实验数据如下:
已知:(1)第5次加酸后,烧杯底部剩余不溶固体2.1g。泥沙成分为SiO2,它不溶于水,也不与盐酸发生反应。
(2)Na2CO3 + 2HCl 2NaCl + H2O + CO2↑
请回答下列问题:
(1)反应过程中产生二氧化碳的总质量为 。
(2)反应结束时得到氯化钠的质量。
(3)碳酸钠样品中钠元素与氯元素的质量比。
| 加入稀盐酸次数 | 1 | 2 | 3 | 4 | 5 |
| 烧杯和烧杯内物质的总质量/g | 132.8 | 170.6 | 208.4 | 246.2 | 286.2 |
(2)Na2CO3 + 2HCl 2NaCl + H2O + CO2↑
请回答下列问题:
(1)反应过程中产生二氧化碳的总质量为 。
(2)反应结束时得到氯化钠的质量。
(3)碳酸钠样品中钠元素与氯元素的质量比。
(1)8.8g (2)35.1g (3)138:71
试题分析:解:(1)由题意可知:前四次中,每加入盐酸40 g后,反应产生2.2g二氧化碳,第5次加入盐酸后,不再有二氧化碳产生,故反应过程中产生二氧化碳的总质量为2.2g×4=8.8g;
(2)设反应中生成的氯化钠的质量为X,参加反应的碳酸钠质量为Y。
Na2CO3 + 2HCl 2NaCl + H2O + CO2↑
106 117 44
Y X 8.8g
117:44=X:8.8g
X=23.4g
106:44=Y:8.8g
Y=21.2g
反应结束时得到氯化钠的质量为35g-21.2g-2.1g+23.4g=35.1g
(3)碳酸钠样品中钠元素与氯元素的质量比为:[21.2g×
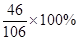 +(35g-21.2g-2.1g)×
+(35g-21.2g-2.1g)×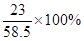 ]:(35g-21.2g-2.1g)×
]:(35g-21.2g-2.1g)×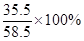 =138:71。
=138:71。答:(1)反应过程中产生二氧化碳的总质量为8.8g。
(2)反应结束时得到氯化钠的质量是35.1g。
(3)碳酸钠样品中钠元素与氯元素的质量比138:71。
点评:根据化学方程式计算,要注意解题的步骤,设、写、找、列、解、答。
某元素的质量分数=
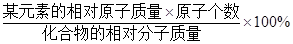 。
。
练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目

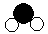
 ”分别表示氢和氧两种元素的原子。(已知氢、氧两种原子的相对原子质量分别为:H-1 O-16)
”分别表示氢和氧两种元素的原子。(已知氢、氧两种原子的相对原子质量分别为:H-1 O-16)