题目内容
【题目】为测定一标签破损(如图)的钙片中碳酸钙的含量,某同学做了如下实验:取10片钙片,放入干燥、洁净的烧杯中,再向烧杯中滴加某浓度稀盐酸,当加入50g稀盐酸,恰好完全反应(钙片中其他成分不溶于水,也不和稀盐酸反应,反应中产生的气体全部放出),反应后称量烧杯内剩余物质的质量为65.6g

(1)反应中生成_____g二氧化碳,该钙片中碳酸钙的质量分数为_____;
(2)试计算反应中所使用的稀盐酸中HCl的质量分数____。
【答案】4.4 50% 14.6%
【解析】
(1)因为碳酸钙和稀盐酸反应放出二氧化碳,根据质量守恒定律可知,烧杯中的物质减少的质量就是生成的二氧化碳的质量,所以生成二氧化碳的质量为:2g×10+50g-65.6g=4.4g;
(2)设10片片剂中碳酸钙的质量为x,消耗盐酸中的氯化氢质量为y。
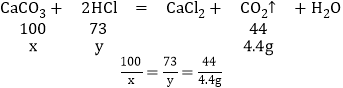
x=10g,y=7.3g
碳酸钙的质量分数:![]() ×100%=50%;
×100%=50%;
(2)所用稀盐酸的溶质质量分数:![]() ×100%=14.6%
×100%=14.6%

 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
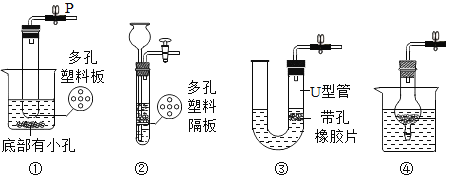
新黄冈兵法密卷系列答案【题目】如图是实验室制取气体的常用装置,请根据图回答下列问题。
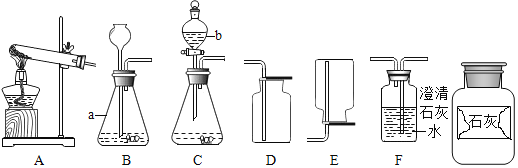
(1)写出图中标有序号的仪器名称:a______;b______。
(2)若使用装置A制取氧气,应______(填改进措施)方可继续实验,其化学方程式是______。
(3)某广口瓶上的标签已破损,只剩下“石灰”两个字,已知该样品未变质。某兴趣小组设计实验探究该药品的成分,请完成以下实验报告。
实验步骤 | 实验现象 | 结论 |
取少量瓶中的固体于烧杯中,加入适量水,并感知烧杯壁的温度 | ______ | 固体不是生石灰 |
取上述烧杯中的少量上层清液于试管中,滴加酚酞试液 | 无明显现象 | 固体不是熟石灰 |
取少量瓶中的固体于装置B中,加入适量稀盐酸 | 产生大量气泡,装置F中的澄清石灰水变浑浊 | F中涉及化学方程式为 ______ |
(4)确定药品的成分后,兴趣小组选用了图中的______(填序号),可实现控制反应的发生与停止。