题目内容
【题目】某氢氧化钙粉末中含有碳酸钙杂质.现取样品15g于锥形瓶中并加适量水搅拌得悬浊液,然后向锥形瓶中滴加稀盐酸,充分反应,测得加入稀盐酸的质量与反应生成气体的质量关系如图所示。

(1)生成二氧化碳的质量是 g;
(2)加入60g稀盐酸后所得溶液中含有的溶质是 、 (填化学式);
(3)计算样品中碳酸钙的质量分数(写出计算过程,结果精确到0.1%).
【答案】(1)2.2g (2)CaCl2;HCl; (3)33.3%
【解析】
试题分析:
(1)由题目中图可以看出:当加入稀盐酸的质量为45g时,石灰石中的碳酸钙完全反应且生成二氧化碳的质量为2.2g;
(2)由图示可知,加入60g稀盐酸后盐酸过量,故溶液中含有的溶质是氯化钙和氯化氢;
(3)利用化学方程式,根据反应的质量比即可计算出碳酸钙的质量。
设样品中碳酸钙的质量分数为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
15g×x 2.2g
![]()
x=33.3%
答:略

【题目】酸溶液和碱溶液混合会发生怎样的变化呢?某班级同学开展如图1所示相关的实验.下面是两个小组的实验
记录与分析.请根据要求回答问题:
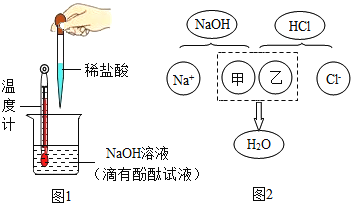
(1)甲组同学往一定体积10%的氢氧化钠溶液样品中滴加10%的盐酸(室温下),反应中溶液温度的变化记录如下:
加入盐酸的体积(V)/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
溶液温度上升 (△t)/℃ | 5.6 | 9.8 | 12.1 | 16.3 | 18.5 | 17.1 | 15.2 | 14.6 | 13.5 | 12.6 |
根据上表数据分析:
①当加入盐酸体积为__mL时,表明NaOH与HCl恰好完全反应.此判断的依据是__.
②当加入6mL盐酸时,烧杯中溶液仍然呈红色,该溶液中含有的溶质有酚酞和__.
③教材指出:酸与碱中和反应的结果是酸和碱各自的特性都消失.图2描述的是氢氧化钠与盐酸反应的微观实质,请从微观的角度分析,甲、乙处应填入的化学符号依次是__、__.
(2)请你参与完成乙组同学的实验记录与分析.
实验操作 | 实验现象 | 分析与结论 |
步骤一:往装有氢氧化钠溶液样品的试管中先滴加2~3滴的 酚酞试液,再逐滴加入稀盐酸 | 现象一:有气泡产生 现象二:__ | 1.该氢氧化钠溶液样品已变质 2.溶液碱性消失 |
步骤二:取步骤一反应后的溶液,然后逐滴加入该氢氧化钠溶液样品 | 现象一:有气泡产生 现象二:溶液开始不变色,后逐渐变成红色 | 1.产生“气泡”这一现象对应的化学方程式为__ 2.所取的步骤一反应后的溶液pH__7(填“<”、“=”或“>”) |