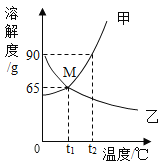
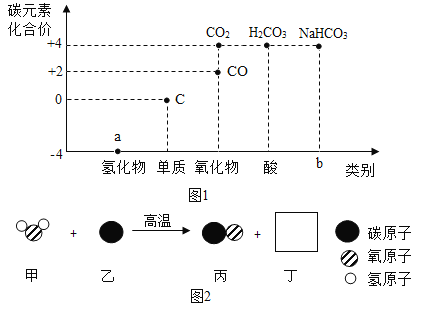
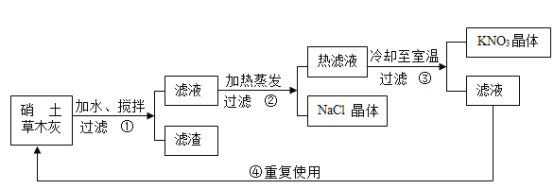
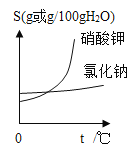
题目内容
【题目】现有一包黑色粉末,可能含有铁粉、木炭粉、二氧化锰中的一种或几种。请根据以下实验流程图进行推断,并完成以下内容:
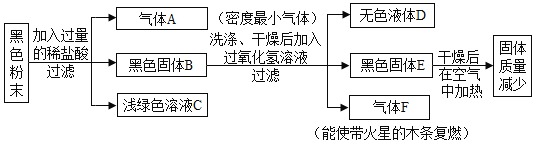
(1)气体A的化学式_____________;
(2)写出生成气体F的化学方程式:________________________________;
(3)写出C溶液是_____________(填化学式);
(4)推断这包黑色粉末的成分_____________。
【答案】(1)H2
(2)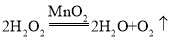
(3)FeC12、HCl
(4)铁粉、木炭粉、二氧化锰
【解析】
向黑色粉末中加入过量的稀盐酸,产生气体A、黑色固体B、浅绿色溶液C,气体A为密度最小的气体,可推出气体A为氢气,由溶液为浅绿色,可推出C溶液中含氯化亚铁,由此可得出黑色粉末中含铁,向黑色固体B中加入过氧化氢溶液,产生无色液体D、黑色固体E和气体F,气体F能使带火星的木条复燃,可推出F为氧气,故黑色固体中含二氧化锰,过氧化氢在二氧化锰的催化下分解为水和氧气,可推出无色液体D为水,黑色固体E在空气中加强热,固体质量减少,木炭粉能与氧气在加热的条件下生成二氧化碳,故黑色固体中含木炭粉。
(1)气体A为氢气,化学式为:H2 ;
(2)气体F为氧气,过氧化氢在二氧化锰的催化下分解为水和氧气,该反应的化学方程式为: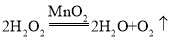 ;
;
(3)C溶液为浅绿色,故是铁与稀盐酸反应生成了氯化亚铁,由于稀盐酸过量,故C溶液是FeC12、HCl;
(4)由分析可知,这包黑色粉末的成分是铁粉、木炭粉、二氧化锰的混合物。

 孟建平名校考卷系列答案
孟建平名校考卷系列答案【题目】古文献记载:距今 5000-4000 年我国古代人们已开始冶铸青铜器(图 1)。青铜器表面常会有一层铜锈,对铜锈开展探究活动。
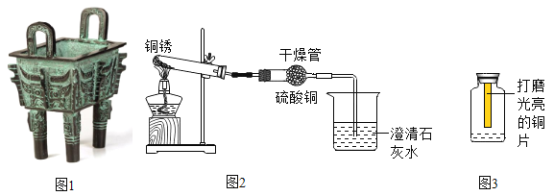
查阅资料:CuSO4+5H2O=CuSO4·5H2O,CuSO4为白色固体,CuSO4·5H2O为蓝色固体
探究 I:探究铜锈的组成
用图 2 所示装置进行实验。观察到澄清石灰水变浑浊,干燥管内白色粉末变为蓝色,试管中固体由绿色变为黑色。
探究Ⅱ:探究铜生锈的条件
在探究Ⅰ的基础上,同学们设计了如图 3 所示的装置。在同一实验室的自然环境中,进行了如下两个实验,回答下列问题:
实验序号 | 甲 | 乙 |
实验操作 | 在 250mL 的集气瓶中装有 100mL 氧气、100mLCO2 和 50 毫升水 | 在250mL 的集气瓶中装有200mLCO2 和50毫升水 |
实验现象 | 第 3 天,出现黑色斑点,之后面积逐渐扩大 并增厚,第 9 天略显绿色 | 无明显现象 |
(1)由探究 I 推测,铜锈中含有的元素有________________________。
(2)探究 II 的基本猜想是________________________。
(3)由探究 II 推断,防止铜生锈的思路是________________________。
(4)在上述探究的基础上,关于铜生锈,你还想继续探究的问题是________________________。
(5)针对你提出的问题,验证实验的设计是_____
【题目】实验小组同学验证可燃物燃烧的条件,进行如下实验。
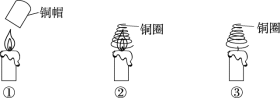
编号 | 实验操作 | 实验现象 |
① | 铜帽加热后,立即罩在蜡烛火焰上 | 蜡烛熄灭 |
② | 铜圈加热后,立即罩在蜡烛火焰上 | 蜡烛继续燃烧 |
③ | 铜圈不加热,直接罩在蜡烛火焰上 | 蜡烛熄灭 |
(1)验证可燃物燃烧需要O2的现象是______。
(2)对比实验②和③,可以得出可燃物燃烧的条件是________。