题目内容
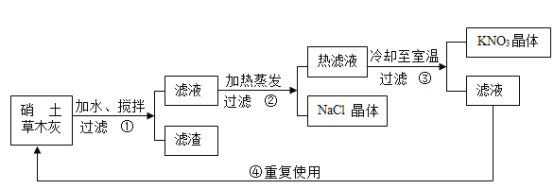
【题目】硝土中含有硝酸镁、硝酸钙、氯化钠等物质,民间曾用硝土和草木灰做原料来制取硝酸钾,其主要生产流程为:
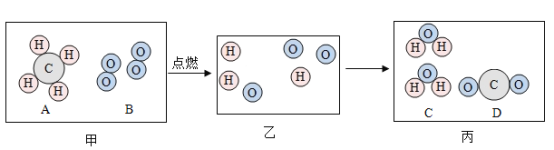
(1)写出步骤①中生成碳酸镁的化学方程式:______,该反应的基本类型是_____。
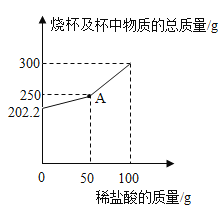
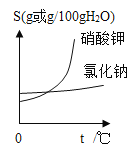
(2)参考下图,解释生产流程中用蒸发结晶得到NaCl晶体,而用冷却结晶得到KNO3晶体的原因:____
(3)在流程图中,滤液可以再利用的理由是______。
【答案】K2CO3+Mg(NO3)2=MgCO3↓+2KNO3 复分解反应 因为氯化钠的溶解度随温度升高增大不多,欲将其结晶只能用蒸发的方法,而KNO3的溶解度随温度升高迅速增大,故可以用冷却热饱和溶液的方法将其结晶 该滤液中还有硝酸钾
【解析】
(1)由题意“硝土中含有硝酸镁、硝酸钙、氯化钠等物质,草木灰的主要成分是碳酸钾,民间曾用硝土和草木灰作原料来制取硝酸钾”则可知生成碳酸镁沉淀的原理为硝酸镁与碳酸钾反应生成碳酸镁沉淀和硝酸钾,反应的化学方程式![]() ;反应符合“‘双交换,价不变’,内项结合,外项结合”,反应为复分解反应;
;反应符合“‘双交换,价不变’,内项结合,外项结合”,反应为复分解反应;
(2)解释生产流程中用蒸发结晶得到NaCl晶体,而用冷却结晶得到KNO3晶体的原因:氯化钠的溶解度随温度升高增大不多,欲将其结晶只能用蒸发的方法,而KNO3的溶解度随温度升高迅速增大,故可以用冷却热饱和溶液的方法将其结晶;
(4)降温结晶析出晶体后的溶液仍为该溶质的饱和溶液,因此,滤液中还有硝酸钾,通过再次操作可继续获得硝酸钾晶体;故填:滤液中还有硝酸钾。

 阅读快车系列答案
阅读快车系列答案【题目】请从A或B两题中任选一个作答,若两题均作答,按A计分。
A  探究二氧化碳与水反应
探究二氧化碳与水反应
B 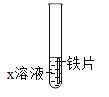 探究铁的金属活动性
探究铁的金属活动性
A | B |
(1)图A探究二氧化碳与水反应的实验操作为_______。 (2)该实验的结论是_____(可用化学方程式表示)。 | (1)图B中,若X溶液为硫酸铜溶液,则反应的化学方程为______。 (2)若X溶液为稀盐酸,观察到有气泡产生,该反应发生的原因是_____。 |