题目内容
【题目】金属在生产和生活中具有这的应用
(1)汽车和我们的目常生活密切相关,制造汽车轮胎的橡胶是_________(填“天然高分子材料”成“有机合成材料”)。
(2)信息一:地壳中含量最多的金属元素是__________(填元素符号)。
信息二:铝的化学性质很活泼.但家用铝制品却很少出现腐蚀现象,原因是:________。
信息三:
金属 性质 | 导电性(100为标准) | 密度(g/cm3) |
铜 | 99 | 8.92 |
铁 | 17 | 7.86 |
铝 | 61 | 2.70 |
综合上述因素,常选用表中种金属中的_________作为高压输电线,原因是_________。
(3)初中化学中通过化学反应得到常见金属的方法有两种,一种是湿法冶金,如在氯化铜和氯化锌的混合溶液中加入一定量的铁粉,充分反应后过滤,得到新的金属和滤液,滤液中一定含有的溶质有__________(填化学式):另一种是火法冶金,如将炉甘石(ZnCO3),赤铜(Cu2O)和木炭粉混合后高温加热,得到一种外观似金子的锌和铜的合金。已知炉甘石受热分解的化学方程式是![]() ,请写出生成锌的化学方程式:______________。
,请写出生成锌的化学方程式:______________。
【答案】有机合成材料 Al 铝和氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化 铝 导电性较强 ,密度较小(合理即可) FeCl2、ZnCl2 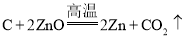
【解析】
(1)汽车和我们的日常生活密切相关,制造汽车轮胎的橡胶与塑料、合成纤维都是有机合成材料;
(2)信息一:地壳中含量最多的金属元素是铝,符号为Al;
信息二:铝的化学性质很活泼,但家用铝制品却很少出现腐蚀现象,原因是: 铝的化学性质活泼,常温下就能和空气中的氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化;
信息三: 常选用表中种金属中的铝作为高压输电线,原因是导电性较强 ,密度较小(合理即可);
(3)在金属活动顺序表中,金属的位置越靠前,金属的活动性越强。位置靠前的金属能将位于其后的金属从它的盐溶液中置换出来。在金属活动性顺序中,三种金属的活动性顺序是:锌>铁>氢>铜,在氯化铜和氯化锌的混合溶液中加入一定量的铁粉,铁与氯化铜反应生成氯化亚铁和铜,与氯化锌不反应,充分反应后过滤,得到的滤液中一定含有的溶质有氯化亚铁和氯化锌,化学式为FeCl2、ZnCl2;已知炉甘石受热分解的化学方程式是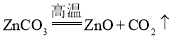 ,生成锌的化学反应是碳和氧化锌在高温条件下生成锌和二氧化碳,方程式:
,生成锌的化学反应是碳和氧化锌在高温条件下生成锌和二氧化碳,方程式: 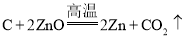 。
。

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案【题目】小杨往NaOH溶液中滴加稀硫酸,溶液无明显变化,他和小组同学以“酸与碱能否发生反应”为课题进行了科学探究,请回答下列问题。
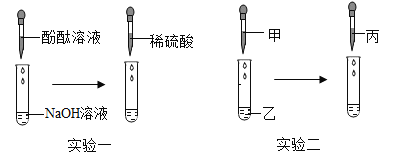
[实验一] (1)向NaOH溶液中先滴入几滴酚酞溶液,振荡,再滴入稀硫酸,观察到溶液由____________色变为无色,该反应的化学方程式为___________________________。
(2)继续往上述试管逐滴滴入NaOH溶液,不断振荡,如果观察到_____________现象,证明了滴加的稀硫酸过量。
[实验二.]按照“证明反应后NaOH消失了”这个角度,同学们又设计了实验二,利用NaOH溶液、CuSO4溶液、稀盐酸同样证明了酸和碱能发生反应,其中试剂丙是_______________。
[拓展延伸] CO2通入NaOH溶液中也无明显现象,CO2 与NaOH溶液能否发生化学反应呢?小组同学对此继续探究。
[查阅资料]常温下NaOH、Na2CO3在水、乙醇中的溶解性如下表所示:
溶质 溶解性 溶剂 | 氢氧化钠 | 碳酸钠 |
水 | 极易溶 | 易溶 |
乙醇 | 易溶 | 微溶 |
[实验三]小组同学设计了多角度验证CO2与NaOH溶液反应的实验,如实验三图所示 (装置已连接好,气密性良好,止水夹a和b已关闭,部分仪器已略去)。.
[温馨提示] CO2与乙醇不反应,本实验条件下CO2在乙醇中的溶解忽略不计。
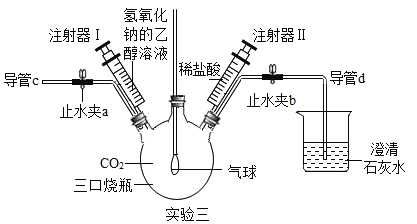
(1)把注射器I中氢氧化钠的乙醇溶液注入充满CO2的三口烧瓶中,轻轻振荡,观察到的现象是_______________。写出该反应的化学方程式_______________。
(2)把导管d移出石灰水,打开止水夹a、b,再从导管C端往三口烧瓶中鼓入N2,目的是_______________。过了一段时间后,先把导管d放入澄清石灰水中,接着关闭止水夹a,再把注射器Ⅱ中的稀盐酸注入三口烧瓶内,观察到三口烧瓶中产生气泡,烧杯中的澄清石灰水变浑浊。此实验从_______________角度证明了CO2与NaOH溶液发生了反应。
[总结归纳]对于无明显现象的反应,可以通过改变实验装置,创设新的情境,观察到明显的反应现象,从而判断反应的发生。