题目内容
【题目】向一定量CuSO4和MgSO4的混合溶液中加入铁粉和锌粉,成分反应后过滤,得到溶液A和固体B,如图所示
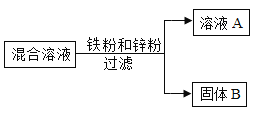
(1)若向固体B上滴加盐酸有气泡产生,则固体B一定含有哪些物质_____?
(2)若反应后所得溶液为无色,则反应后所得溶液的质量与反应前相比,是增大、减小还是不变_____?为什么?_____(用化学方程式表示)
【答案】Fe和Cu或铁和铜 增大 Zn+CuSO4=ZnSO4+Cu
【解析】
根据排在前面的金属可以将排在后面的金属从其盐溶液中置换出来进行分析。
排在前面的金属可以将排在后面的金属从其盐溶液中置换出来,向一定量CuSO4和MgSO4的混合溶液中加入铁粉和锌粉,锌、铁都不会与硫酸镁反应,锌会先与硫酸铜反应,铁再与硫酸铜反应,所以
(1)向固体B上滴加盐酸有气泡产生,所以固体B一定含有铁和置换出的铜;
(2)反应后所得溶液为无色,所以溶液中不含硫酸铜,铜被完全置换出来,每65份质量的锌会置换出64份质量的铜,所以反应后所得溶液的质量与反应前相比,质量增大,化学方程式为;Zn+CuSO4=ZnSO4+Cu。

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目