题目内容
【题目】由于二氧化碳与氢氧化钠溶液反应无明显现象,对此同学们展开了探究,
(提出问题)二氧化碳与氢氧化钠溶液能否发生反应?
(查阅资料)①已知碳酸氢钠溶液不与二氧化碳反应。
②常温下,氢氧化钠、碳酸钠在乙醇中的溶解性如下。
溶剂 | 乙醇 | |
溶质 | 氢氧化钠 | 碳酸钠 |
溶解性 | 易溶 | 难溶 |
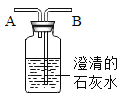
(方案设计)小明同学设计了如图所示装置进行探究。
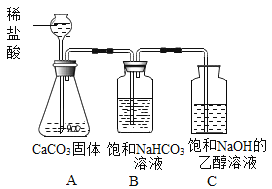
(实验探究)
(1)溶液配制。C中饱和溶液:将一定质量的氢氧化钠固体加入到一定体积的乙醇中,用玻璃棒不断搅拌,使其成为饱和氢氧化钠的乙醇溶液。玻璃棒的作用是____。判断C中饱和溶液形成的现象是____。
(2)进行实验,按图所示装置加入药品后进行实验。B装置的作用是____,C中观察到的现象是____。
(实验结论)
(3)由此小明得出二氧化碳与氢氧化钠发生了化学反应,反应的化学方程式为____。
(反思交流)
(4)小刚同学认为小明的实验还不足以证明二氧化碳与氢氧化钠发生了化学反应,还应补充的实验是____。
【答案】搅拌,加速溶解 有固体不溶解 去除CO2中的HCl气体 生成白色沉淀 ![]() 将二氧化碳通入乙醇溶液,观察现象
将二氧化碳通入乙醇溶液,观察现象
【解析】
(1)不断搅拌的目的是加速溶解,故玻璃棒的作用是:搅拌,加速溶解;有固体未溶解是饱和溶液,判断C中饱和溶液形成的现象是有固体不溶解,故填:有固体不溶解。
(2)饱和碳酸氢钠可以吸收二氧化碳中的氯化氢气体,B装置的作用是去除CO2中的HCl气体,CO2通入饱和NaOH乙醇溶液中,会生成碳酸钠,碳酸钠在乙醇中难溶,故会生成白色沉淀,故填:去除CO2中的HCl气体;生成白色沉淀;
(3)氢氧化钠和二氧化碳反应生成碳酸钠和水,化学方程式为:
![]() 故填:
故填:![]() ;
;
(4)小明的实验只是说明二氧化碳会与氢氧化钠反应,还应该验证二氧化碳和乙醇的是否反应,所以补充的实验是将二氧化碳通入乙醇溶液,观察现象;故填:将二氧化碳通入乙醇溶液,观察现象

【题目】下表是KNO3和Ca(OH)2在不同温度时的溶解度。下列说法错误的是( )
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110.0 |
Ca(OH)2 | 0.19 | 0.17 | 0.16 | 0.14 | 0.13 | 0.11 | |
A.硝酸钾的溶解度随温度的升高而增大,氢氧化钙的溶解度随温度的升高而减小
B.硝酸钾中含有少量氢氧化钙时,可以用冷却热饱和溶液的方法提纯硝酸钾
C.氢氧化钙的不饱和溶液转化为饱和溶液可以采取升高温度的方法
D.20℃时,氢氧化钙饱和溶液的溶质质量分数为 0.17%
【题目】某同学发现上个月做实验用的氢氧化钠溶液忘记了盖瓶盖。对于该溶液是否变质,该同学对此进行了探究。请你一起完成下列实验报告。
(1)(提出问题1)该溶液是否变质?
(实验探究1)
实验步骤 | 实验现象 | 解释与结论 |
取少量该溶液放于试管中,滴加足量稀盐酸 | 有____产生 | 说明该溶液已变质,变质的原因是_____(请用化学方程式表示) |
(2)(提出问题2)该溶液变质程度怎样?
(提出猜想)猜想一:已完全变质,该溶液中溶质只含Na2CO3 猜想二:部分变质,该溶液中溶质含有_____
(查阅资料)氯化钡溶液呈中性。
(实验探究2)
实验步骤 | 实验现象 | 结论 |
先取少量该溶液放于试管中,加入过量氯化钡溶液 | 有____生成 | 猜想____成立 |
静置,取上层清液于另一支试管中,加入2-3滴酚酞溶液 | 上层清液变红 |
(3)反思:在(实验探究2)中加入过量的氯化钡溶液的目的是什么?___________________。
(4)拓展:除去部分变质的氢氧化钠溶液中的杂质,方法是___________________(用化学方程式表示)。
(5)提升:为进一步探究氢氧化钠的变质程度,小明称取 18.6 g 氢氧化钠固体样品放入烧杯中,向其中逐滴加入稀盐酸,到不再产生气泡为止,共消耗稀盐酸 100 g,反应后称得烧杯中溶液的质量为 114.2 g。该氢氧化钠的变质程度(即变质的氢氧化钠占变质前的氢氧化钠的质量分数为)__________________。