��Ŀ����
����Ŀ��ijͬѧ�����ϸ�����ʵ���õ�����������Һ�����˸�ƿ�ǡ����ڸ���Һ�Ƿ���ʣ���ͬѧ�Դ˽�����̽��������һ���������ʵ�鱨�档
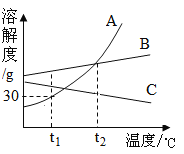
��1�����������1������Һ�Ƿ���ʣ�
��ʵ��̽��1��
ʵ�鲽�� | ʵ������ | ��������� |
ȡ��������Һ�����Թ��У��μ�����ϡ���� | ��____���� | ˵������Һ�ѱ��ʣ����ʵ�ԭ����_____�����û�ѧ����ʽ��ʾ�� |
��2�����������2������Һ���ʳ̶�������
��������룩����һ������ȫ���ʣ�����Һ������ֻ��Na2CO3 ����������ֱ��ʣ�����Һ�����ʺ���_____
���������ϣ��Ȼ�����Һ�����ԡ�
��ʵ��̽��2��
ʵ�鲽�� | ʵ������ | ���� |
��ȡ��������Һ�����Թ��У���������Ȼ�����Һ | ��____���� | ����____���� |
���ã�ȡ�ϲ���Һ����һ֧�Թ��У�����2-3�η�̪��Һ | �ϲ���Һ��� |
��3����˼���ڣ�ʵ��̽��2���м���������Ȼ�����Һ��Ŀ����ʲô��___________________��
��4����չ����ȥ���ֱ��ʵ�����������Һ�е����ʣ�������___________________���û�ѧ����ʽ��ʾ����
��5��������Ϊ��һ��̽���������Ƶı��ʳ̶ȣ�С����ȡ 18.6 g �������ƹ�����Ʒ�����ձ��У���������μ���ϡ���ᣬ�����ٲ�������Ϊֹ��������ϡ���� 100 g����Ӧ��Ƶ��ձ�����Һ������Ϊ 114.2 g�����������Ƶı��ʳ̶ȣ������ʵ���������ռ����ǰ���������Ƶ���������Ϊ��__________________��
���𰸡����� ![]() NaOH��Na2CO3 ��ɫ���� �� ������Һ�е�̼���ƣ��ų�����
NaOH��Na2CO3 ��ɫ���� �� ������Һ�е�̼���ƣ��ų����� ![]() 50%
50%
��������
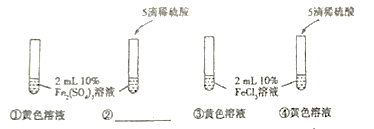
[ʵ��̽��1]
������������ѱ��ʣ���Һ�оͻ���̼���ơ�ȡ��������Һ�����Թ��У��μ�����ϡ���ᣬ�����ݲ�����������̼���Ʒ�Ӧ����������̼���壬˵�����������ѱ��ʡ��������Ʊ�������Ϊ������еĶ�����̼��Ӧ����̼���ƺ�ˮ������ʽΪ![]() ��
��
[�������]
����������Һ����ȫ���ʣ�����Һ�����ʾ�û���������ƣ�ֻ��Na2CO3������������Ʋ��ֱ��ʣ�����Һ�����ʼ�����������Ҳ��̼���ơ�
[ʵ��̽��2]
���Ҫ֤�����ʳ̶ȣ���Ҫ֤����Һ���Ƿ����������ƣ���Ϊ�������ƺ�̼������Һ���ʼ��ԣ�������֤����������ʱ������Ҫ��̼���Ƴ�ȥ���ų����š������ǣ���ȡ��������Һ�����Թ��У���������Ȼ�����Һ���а�ɫ������������Ϊ�Ȼ�����̼���Ʒ�Ӧ�����ɰ�ɫ��̼�ᱵ���������ã�ȡ�ϲ���Һ����һ֧�Թ��У�����2-3�η�̪��Һ���ϲ���Һ���ɫ��˵����Һ�ʼ��ԣ���ԭ��Һ�к����������ƣ���˲����������
��3������������Ȼ�����Һ��Ŀ���ǰ�̼���Ƴ�ȥ��������ż����������ơ�
��4�����ֱ��ʵ�����������Һ�е�������̼���ƣ���ȥ̼���Ƶķ�����������������������̼���Ʒ�Ӧ�������������ƺ�̼��Ƴ��������˼��ɳ�ȥ��̼���Ƶõ�����������Һ����Ӧ����ʽΪ��![]() ��
��
��5�����������غ㶨�ɣ����ɶ�����̼���������Ϊ��![]() ��
��
���ѱ��ʵ��������Ƶ�����ΪX����������̼���Ƶ�����ΪY��
�����������ն�����̼����̼���ƣ�̼���������ᷴӦ���ɶ�����̼�����ǵ�������ϵ�ǣ�
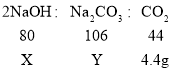
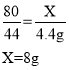
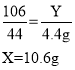
���������Ƶı��ʳ̶�Ϊ��![]() ��
��

 ȫ��������ϵ�д�
ȫ��������ϵ�д�����Ŀ�����ڶ�����̼������������Һ��Ӧ���������Դ�ͬѧ��չ����̽����
��������⣩������̼������������Һ�ܷ�����Ӧ��
���������ϣ�����֪̼��������Һ���������̼��Ӧ��
�ڳ����£��������ơ�̼�������Ҵ��е��ܽ������¡�
�ܼ� | �Ҵ� | |
���� | �������� | ̼���� |
�ܽ��� | ���� | ���� |
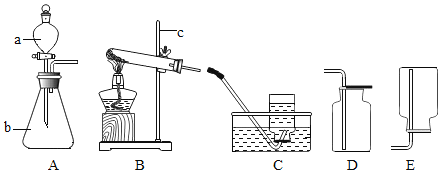
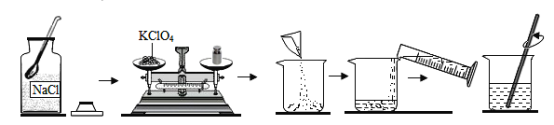
��������ƣ�С��ͬѧ�������ͼ��ʾװ�ý���̽����
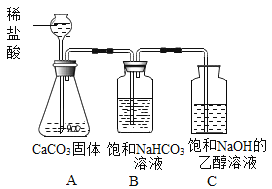
��ʵ��̽����
(1)��Һ���ơ�C�б�����Һ����һ���������������ƹ�����뵽һ��������Ҵ��У��ò��������Ͻ��裬ʹ���Ϊ�����������Ƶ��Ҵ���Һ����������������____���ж�C�б�����Һ�γɵ�������____��
(2)����ʵ�飬��ͼ��ʾװ�ü���ҩƷ�����ʵ�顣Bװ�õ�������____��C�й۲쵽��������____��
��ʵ����ۣ�
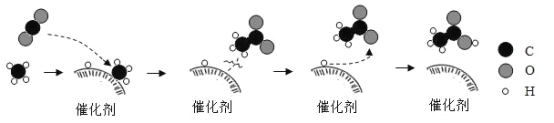
(3)�ɴ�С���ó�������̼���������Ʒ����˻�ѧ��Ӧ����Ӧ�Ļ�ѧ����ʽΪ____��
����˼������
(4)С��ͬѧ��ΪС����ʵ�黹������֤��������̼���������Ʒ����˻�ѧ��Ӧ����Ӧ�����ʵ����____��