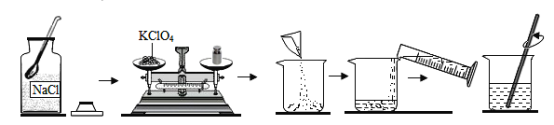
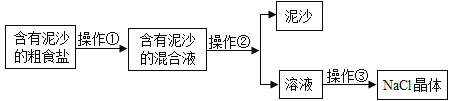
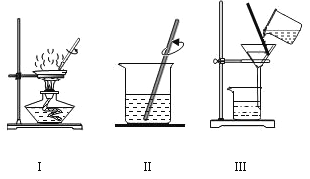
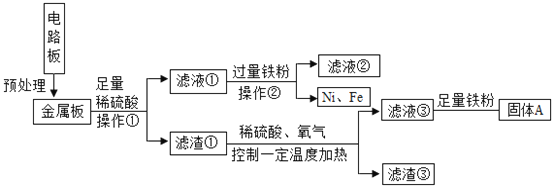
题目内容
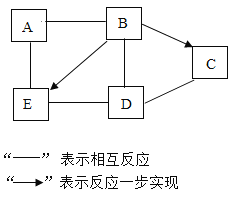
【题目】A~E是中学化学常见的五种不同类别的物质,它们之间的关系如图所示(部分反应物、生成物及反应条件已略去)。其中A是黑色粉末;D易溶于水;E中金属的质量分数为40%,常用于配制农药波尔多液;则A与B反应的化学方程式为__________________;C与D反应的化学方程式为____________;D与E反应可观察到的现象为____________________。
【答案】Fe + H2SO4 = FeSO4 + H2↑ 2NaOH + CO2 = Na2CO3 + H2O 产生蓝色沉淀
【解析】
A-E是初中化学常见的五种不同类别的物质,E中金属的质量分数为40%,常用于配制农药波尔多液,硫酸铜中铜的质量分数=![]() ,硫酸铜与氢氧化钙可配制农药波尔多液,所以E是硫酸铜;A是黑色粉末,A能与E(硫酸铜)反应,铁粉是黑色固体,铁能与硫酸铜反应,所以A是铁,B能转化为E(硫酸铜),能与A(铁)反应,氧化铜与硫酸反应生成硫酸铜,铁能与硫酸反应,所以B是硫酸; D易溶于水,D能与E(硫酸铜),能与B(硫酸)反应,氢氧化钠易溶于水,能与硫酸铜反应生成硫酸钠和氢氧化铜,能与硫酸反应生成硫酸钠和水,所以D是氢氧化钠; A-E是初中化学常见的五种不同类别的物质,A(铁)属于单质,E(硫酸铜)属于盐类,B(硫酸)属于酸类,D(氢氧化钠)属于碱,则C为氧化物,B(硫酸)能转化为C,D(氢氧化钠)能与C反应,硫酸与碳酸钠反应生成硫酸钠、水和二氧化碳,二氧化碳与氢氧化钠反应生成碳酸钠和水,所以C为二氧化碳。经过验证,推导正确。
,硫酸铜与氢氧化钙可配制农药波尔多液,所以E是硫酸铜;A是黑色粉末,A能与E(硫酸铜)反应,铁粉是黑色固体,铁能与硫酸铜反应,所以A是铁,B能转化为E(硫酸铜),能与A(铁)反应,氧化铜与硫酸反应生成硫酸铜,铁能与硫酸反应,所以B是硫酸; D易溶于水,D能与E(硫酸铜),能与B(硫酸)反应,氢氧化钠易溶于水,能与硫酸铜反应生成硫酸钠和氢氧化铜,能与硫酸反应生成硫酸钠和水,所以D是氢氧化钠; A-E是初中化学常见的五种不同类别的物质,A(铁)属于单质,E(硫酸铜)属于盐类,B(硫酸)属于酸类,D(氢氧化钠)属于碱,则C为氧化物,B(硫酸)能转化为C,D(氢氧化钠)能与C反应,硫酸与碳酸钠反应生成硫酸钠、水和二氧化碳,二氧化碳与氢氧化钠反应生成碳酸钠和水,所以C为二氧化碳。经过验证,推导正确。
根据以上分析可知:A与B的反应是铁与硫酸反应生成硫酸亚铁和氢气,反应的化学方程式为:Fe + H2SO4 = FeSO4 + H2↑;
C与D的反应是二氧化碳与氢氧化钠反应生成碳酸钠和水,反应的化学方程式为2NaOH + CO2 = Na2CO3 + H2O;
D与E的反应是氢氧化钠与硫酸铜反应生成硫酸钠和氢氧化铜,可观察到的现象为产生蓝色沉淀。

 名校课堂系列答案
名校课堂系列答案【题目】由于二氧化碳与氢氧化钠溶液反应无明显现象,对此同学们展开了探究,
(提出问题)二氧化碳与氢氧化钠溶液能否发生反应?
(查阅资料)①已知碳酸氢钠溶液不与二氧化碳反应。
②常温下,氢氧化钠、碳酸钠在乙醇中的溶解性如下。
溶剂 | 乙醇 | |
溶质 | 氢氧化钠 | 碳酸钠 |
溶解性 | 易溶 | 难溶 |
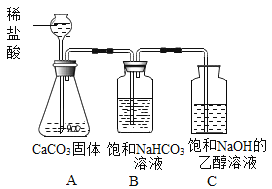
(方案设计)小明同学设计了如图所示装置进行探究。
(实验探究)
(1)溶液配制。C中饱和溶液:将一定质量的氢氧化钠固体加入到一定体积的乙醇中,用玻璃棒不断搅拌,使其成为饱和氢氧化钠的乙醇溶液。玻璃棒的作用是____。判断C中饱和溶液形成的现象是____。
(2)进行实验,按图所示装置加入药品后进行实验。B装置的作用是____,C中观察到的现象是____。
(实验结论)
(3)由此小明得出二氧化碳与氢氧化钠发生了化学反应,反应的化学方程式为____。
(反思交流)
(4)小刚同学认为小明的实验还不足以证明二氧化碳与氢氧化钠发生了化学反应,还应补充的实验是____。
【题目】阅读下面科普短文。
(资料1)融雪剂按组成分为有机融雪剂和无机融雪剂。
有机融雪剂的主要成分为醋酸钾,一般用于机场等重要场所。
无机融雪剂以氯化钠、氯化钙等为主要成分,其融雪原理与相同条件下,不同浓度的食盐水的凝固点有关(见下表)。
溶剂质量(g) | 100 | 100 | 100 | 100 | 100 |
溶质质量(g) | 0 | 3.6 | 7.5 | 11.1 | 29.9 |
凝固点(℃) | 0 | -2.3 | -4.2 | -6.3 | -21 |
(资料2)钛(Ti)是一种银白色的金属。它具有良好的耐高温、耐低温、抗酸碱以及高强度、低密度的特点,广泛用于航空工业;它无毒且具有优良的生物相容性,是非常理想的医用金属材料,可用来制造人造骨等。金属钛不仅能在空气中燃烧,也能在二氧化碳或氮气中燃烧。在稀有气体和高温条件下,用四氯化钛和镁发生置换反应可制备金属钛。
依据资料,回答下列问题:
(1)若飞机场使用融雪剂,应选择融雪剂的类别是___________。
(2)从无机融雪剂的融雪原理得出:100g溶剂中,溶质质量和凝固点的关系是_______________。
(3)钛金属广泛应用于航空工业的原因是____________________(答出2条即可)。
(4)金属钛着火时___________(填“能”或“不能”)用二氧化碳灭火。
(5)四氯化钛制备金属钛的化学方程式是__________________________________。