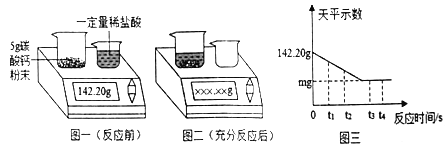
题目内容
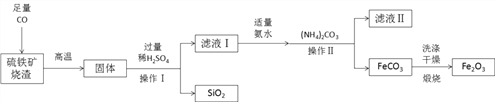
【题目】某硫酸厂产生的烧渣(主要含Fe2O3、Fe3O4、FeO,还有少量难溶于水和酸的SiO2)可用于制备FeCO3,其流程如下:
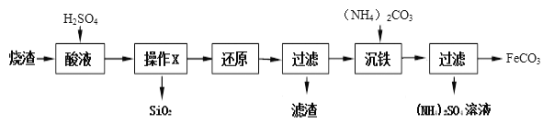
回答下列有关问题:
(1)“烧渣”中所含的四种物质,其类别都属于_______。写出FeO酸溶时发生反应的化学方程式________________________。
(2)“操作X”的名称为_______,在实验室进行该操作用到的玻璃仪器有:烧杯、玻璃棒和______。
(3)“还原”的的是将溶液中的Fe2(SO4)3转化为FeSO4,此过程中发生化合价改变的元素是______。
(4)(NH4)2CO3中,氮元素与碳元素的质量之比为__________。
(5)硫酸铵该在农业上的用途是______,在使用过程中的注意事项是___________。。从硫酸铵溶液中提纯得到硫酸铵晶体,其操作步骤分别是加热浓缩、________、过滤、洗涤、干燥。
【答案】 氧化物(纯净物) FeO+H2SO4=FeSO4+H2O 过滤 漏斗 Fe(铁) 7:3 作氮肥 避免与碱性物质混合使用(不宜长期使用造成土壤酸化板结) 冷却结晶
【解析】(1)由两种元素组成,且其中一种是氧元素的化合物叫氧化物,“烧渣”中所含的四种物质,其类别都属于氧化物。金属氧化物和酸反应生成盐和水,FeO酸溶时发生反应的化学方程式FeO+H2SO4=FeSO4+H2O;(2)过滤适用于将难溶性固体与液体分离,“操作X”的名称为过滤,在过滤操作用到的玻璃仪器有:烧杯、玻璃棒和漏斗;(3)化合物中元素的化合价的代数和为零,硫酸根显-2价,Fe2(SO4)3中铁显+3价, FeSO4中铁元素显+2价,Fe2(SO4)3转化为FeSO4过程中发生化合价改变的元素是铁;(4)(NH4)2CO3中,氮元素与碳元素的质量之比为14×2:12=7:3;(5)硫酸铵中含有氮元素,该在农业上的用途是作氮肥;铵根离子和氢氧根离子结合生成水和氨气,使肥效降低,故铵态氮肥在使用过程中的注意事项是避免与碱性物质混合使用。从硫酸铵溶液中提纯得到硫酸铵晶体,其操作步骤分别是加热浓缩、降温结晶、过滤、洗涤、干燥。

 阅读快车系列答案
阅读快车系列答案