��Ŀ����
����Ŀ����ѧ��ȤС��Ϊ��֤�����غ㶨�ɣ���������ʦָ���£�����þ���ڿ�����ȼ�յ�ʵ�顣
��1��д��þ����������Ӧ�Ļ�ѧ����ʽ��_____��
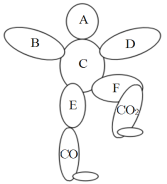
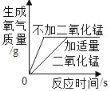
��2��С������ȼ�����ù���������������ĵ�þ�����������ݴ���Ϊ�÷�Ӧ����ѭ�����غ㶨�ɡ���_____��ͬ����������ͬ������С���Ĺ۵㣬������_____��
��3��С�찴��ͼװ�ý���ʵ�飬��֤�������غ㶨�ɣ�ȴ���ֲ����л���������ɫ���塣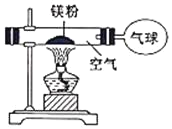
��������⣩��ɫ������ʲô���ʣ�
���������ϣ���þ�뵪����Ӧ���ɻ�ɫ�ĵ���þ��Mg3N2�����壻�ڵ���þ����ˮ���ҷ�Ӧ����������
���������룩��ɫ����Ϊ����þ��
��ʵ��̽�����������ʵ�飬��֤���룺
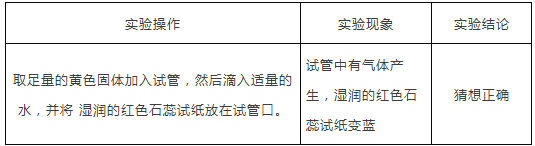
ʵ����� | ʵ������ | ʵ����� |
ȡ�����Ļ�ɫ��������Թܣ�Ȼ�����������_____������_____�����Թܿ� | _____ | ������ȷ |
����˼�뽻����
��ͨ������̽��������ȼ����ʲô����ʶ��_____��
�ڿ����е����ĺ���Զ���������ĺ�������þ���ڿ�����ȼ�����ɵ�����þȴԶ���ڵ���þ��������Ϊ_____��
���𰸡�2Mg+O2![]() 2MgO ��ͬ�� ������þ��Ӧ����������þ������þ����������þ������������ ˮ ʪ��ĺ�ɫʯ����ֽ ��ɫʯ����ֽ���� ȼ�ղ�һ��Ҫ�������μӻ�ijЩ����Ҳ�����ڵ�����ȼ�գ����������𰸾��ɣ� ��ͬ�����£�þ������������Ӧ
2MgO ��ͬ�� ������þ��Ӧ����������þ������þ����������þ������������ ˮ ʪ��ĺ�ɫʯ����ֽ ��ɫʯ����ֽ���� ȼ�ղ�һ��Ҫ�������μӻ�ijЩ����Ҳ�����ڵ�����ȼ�գ����������𰸾��ɣ� ��ͬ�����£�þ������������Ӧ
��������
��1��þ�������ڵ�ȼ����������������þ����Ӧ�Ļ�ѧ����ʽΪ��2Mg+O2 ![]() 2MgO��
2MgO��
��2�����еĻ�ѧ�仯����ѭ�����غ㶨�ɣ�������þ��Ӧ����������þ������þ����������þ�����������ͣ�
��3��[��������]���������Ϣ���ɽ����ɵĹ������ʷ���ˮ�У������Ƿ���������������жϣ�����ʵ���������þ��ȼ�յIJ������һֻ�Թ��У���������������ˮ��Ȼ��һʪ��ĺ�ɫʯ����ֽ�����Թܿڣ��۲�������������ɫ��ʯ����ֽ�����ɫ��˵����ɫ����Ϊ����þ��
[��˼�뽻��]
��ͨ��þҲ���ڵ����о���ȼ�տ�֪��ȼ�ղ�һ���������μӣ�
�������Ļ�ѧ���ʱȵ��������ã�þ��������������������Ӧ��
�ʴ�Ϊ��
��1��2Mg+O2 ![]() 2MgO��
2MgO��
��2����ͬ�⣻������þ��Ӧ����������þ������þ����������þ�������������ɣ�
��3��