题目内容
【题目】(7分)溶液是生产生活中常见的物质,依据相关信息回答问题:
资料:硝酸钾的溶解度数据(部分数据已做取整数处理)如下表所示:
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
溶解度/g | 21 | 32 | 46 | 64 | 86 | 110 | 138 |
(1)农业上,硝酸钾用作水溶性肥料,为作物补充氮和钾元素。硝酸钾溶液中的溶质是______。
(2)A、B、C、D四个烧杯中分别盛有100g水,在40℃时,向四个烧杯中分别加入110g、86g、64g、32g硝酸钾,充分溶解,如图所示。
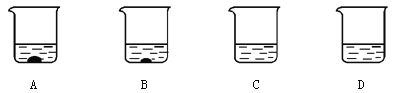
①(填字母序号) 中盛的一定是饱和溶液。
②使B烧杯的溶液升温至50℃时,溶液的质量为 g。
③采用一种方法使A中的固体恰好溶解。对于最终四个烧杯中的溶液,下列说法正确的是 (填字母序号)。
a.溶剂质量可能相等
b.溶质质量可能相等
c.溶质质量分数可能有相等的
d.烧杯A中的溶液质量分数可能最大
(3)工业上利用电解饱和氯化钠溶液可制得重要化工产品氢氧化钠。氢氧化钠溶液可用于治理含二氧化硫的废气并回收二氧化硫,反应的主要流程如下:
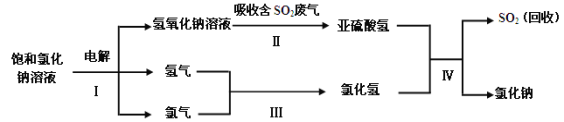
①实际生产中,在一定温度下,配制100t溶质的质量分数为25%的饱和氯化钠溶液,需水的质量为 t。
②以上流程中,可循环使用的物质是 。
③亚硫酸氢钠(NaHSO3)中硫元素的质量分数为 %(计算结果精确到0.1%)。
【答案】(1)硝酸钾(KNO3)(2)①ABC②186③acd(3)①75②氯化钠(NaCl)③30.8
【解析】
试题分析:(1)因为是硝酸钾溶液,故溶质是硝酸钾;(2)①依据饱和溶液的概念可知,A、B中有固体出现,一定是饱和溶液,由40℃时硝酸钾的溶解度64g,可知50g水中溶解32g硝酸钾恰好饱和,D一定不饱和;故选择ABC;②50℃时硝酸钾的溶解度86g,可知100g水中溶解86g硝酸钾恰好饱和,可见使B烧杯的溶液升温至50℃时,硝酸钾完全溶解,溶液的质量为186g.③由于硝酸钾的溶解度随温度的升高而增大,所以饱和溶液变为不饱和可以升高温度,加入溶剂也能使饱和溶液变为不饱和溶液,如果用升高温度的方使固体恰好溶解,则溶剂质量不变,溶质质量增加,溶液质量分数增大,如果为该温度下的饱和溶液,此时溶液质量分数最大,故AB正确;如果用加入溶剂的方使固体恰好溶解,则溶剂、溶质的质量都增加,溶质质量分数可能是相等的,故C正确;无论用什么方法使固体恰好溶解,溶质的质量都会增加,所以D错误;故答案选择abc;(3) ①实际生产中,在一定温度下,配制100t溶质的质量分数为25%的饱和氯化钠溶液,需水的质量为:100t×(1-75%)=75t; ②以上流程中,可循环使用的物质是氯化钠;③亚硫酸氢钠(NaHSO3)中硫元素的质量分数为32/104×100%=30.8%

 名校课堂系列答案
名校课堂系列答案