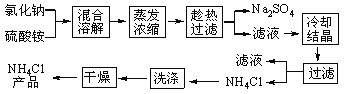
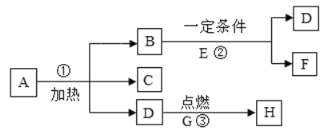
题目内容
【题目】下图是常见的气体发生装置和收集装置,按要求回答问题
(1)写出图中标有①、②的仪器名称:①________;②________。
(2)实验室利用高锰酸钾制取氧气,发生反应的化学方程式为______所用制取氧气的发生装置为(填图中代号)______。装置中缺少了棉花,在试管口放一团棉花的目的是______用装置C收集完氧气后,验满的方法是_____。实验室利用过氧化氢溶液制取氧气,通常需要加入二氧化锰作_____剂,所用的发生装置为_______,
(3)已知甲烷是一种无色、无味,极难溶于水,密度比空气小的气体。实验室常用加热醋酸钠和碱石灰(均为固体)的方法制取甲烷气体。那么实验室制取甲烷气体的发生装置为_____,收集装置为_____。
【答案】试管 酒精灯 ![]() A 防止高锰酸钾颗粒进入导管 将燃着的木条伸到集气瓶口处,如果木条复燃,证明已经集满氧气 催化 B A D或E
A 防止高锰酸钾颗粒进入导管 将燃着的木条伸到集气瓶口处,如果木条复燃,证明已经集满氧气 催化 B A D或E
【解析】
(1)由图可知,仪器①的名称是试管,故填试管;
仪器②的名称是酒精灯,故填酒精灯。
(2)高锰酸钾在加热的条件下反应生成锰酸钾、二氧化锰和氧气,故反应的化学方程式写为:![]() ;
;
利用高锰酸钾制取氧气的反应是加热固体制取气体,应选用固体受热发生装置,即装置A,故填A;
加热高锰酸钾制取氧气时,应在试管口处放一团棉花,防止高锰酸钾颗粒进入导管,故填防止高锰酸钾颗粒进入导管;
氧气具有助燃性,所以用装置C,即向上排空气法收集氧气时,验满的方法是将燃着的木条伸到集气瓶口处,如果木条复燃,证明已经集满氧气,故填将燃着的木条伸到集气瓶口处,如果木条复燃,证明已经集满氧气;
利用过氧化氢溶液制取氧气时需要加入二氧化锰,二氧化锰能够加快过氧化氢分解生成氧气的速率,二氧化锰在反应中作催化剂,故填催化;
利用过氧化氢溶液制取氧气是固体与液体在常温条件下反应生成气体,应选择固液常温发生装置,即装置B,故填B。
(3)实验室常用加热醋酸钠和碱石灰(均为固体)的方法制取甲烷气体,所以该实验的发生装置应该选择固体受热发生装置,即装置A,故填A;
甲烷是一种极难溶于水的气体,则收集甲烷可以选择排水法收集,即装置D,甲烷是一种密度比空气小的气体,所以收集甲烷还可以选择向下排空气法,即装置E,故填D或E。

 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案【题目】某同学想在实验室里用NaOH溶液制取Na2CO3溶液。
查阅资料:①CO2通入NaOH溶液时极易因CO2过量而产生NaHCO3,且无明显现象
②NaHCO3溶液煮沸时不会发生分解
③![]()
④Ca(HCO3)2可溶于水
制取步骤:①量取两份50mL相同浓度的NaOH溶液备用;
②用一份50mLNaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
③小心煮沸②溶液1~2分钟;
④_____,即得Na2CO3溶液。
实验探究:为了检验制得的溶液是否为纯净的Na2CO3溶液,请你与该同学一起完成下列实验探究:
实验步骤 | 实验现象 | 实验结论 | |
取少量制得的溶液于试管中,加入过量的_____溶液 | 产生白色沉淀 | 原来溶液含有Na2CO3 | |
将上步实验所得混合物进行过滤,将滤液分成两份 | 取其中一份加入足量的_____ | 无气泡产生 | 原来制得的溶液中不含_____ |
取另一份加入MgCl2溶液 | _____ | 原来制得的溶液中不含NaOH | |
结论:所制得的溶液为纯净的Na2CO3溶液
评价与反思:有人认为实验步骤③④的顺序对调,即先混合,再煮沸,更合理。你认为对吗?_____请说明理由:_____。
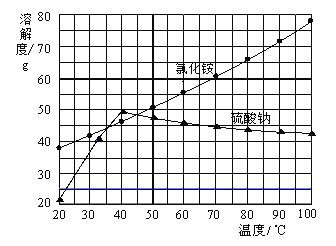
【题目】我国著名化学家侯德榜先生发明了“侯氏制碱法”,其原理中重要的一步是向饱和食盐水中先后通入足量NH3和CO2制备NaHCO3,化学方程式:NaCl+ NH3+CO2+H2O= NaHCO3↓+NH4Cl
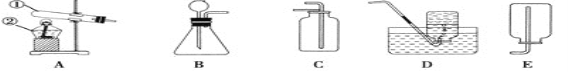
某兴趣小组在实验室模拟该过程,请结合具体的步骤回答下列问题:
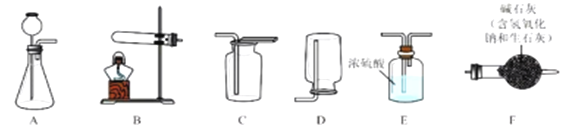
I.气体制备
(1)二氧化碳气体制备
实验室常采用石灰石与稀盐酸反应制备CO2,其化学方程式为_____________。应选择的气体收集装置为______(选填装置对应的字母)。
(2)氨气制备
实验室常用硫酸吸收氨气,防止污染空气,实验室制备NH3的反应原理为:Ca(OH)2(固)+2NH4Cl(固) ![]() CaCl2+2H2O+2NH3↑。现要制备并干燥NH3,所选装置的正确连接顺序为_____→______(选择装置对应的字母)。实验室制备O2也可用上述制备NH3的发生装置,写出用该发生装置制备O2的化学方程式__________。
CaCl2+2H2O+2NH3↑。现要制备并干燥NH3,所选装置的正确连接顺序为_____→______(选择装置对应的字母)。实验室制备O2也可用上述制备NH3的发生装置,写出用该发生装置制备O2的化学方程式__________。
II.NaHCO3制备
物质 | NaHCO3 | NH4Cl |
溶解度/g(20℃) | 9.6 | 37.2 |
(3)根据表格中的溶解度数据,解释20℃产物中NaHCO3能够先从溶液中结晶析出的原因________。
(4)该过程中另一产物NH4Cl在农业生产中常被用作______________。