题目内容
【题目】下列叙述体现了质量守恒定律的是
A.水结成冰前后,质量保持不变
B.50mL水和50mL乙醇混合后总体积小于100mL
C.1.2g碳与3.2g氧气恰好完全反应可生成4.4g二氧化碳
D.100g 质量分数为30%的过氧化氢溶液中,含有30g过氧化氢和70g水
【答案】C
【解析】
A、水结成冰,只是水的状态发生了变化,无新物质生成,属于物理变化,不能体现质量守恒定律,不符合题意;
B、50mL水和50mL乙醇混合后总体积小于100mL,是因为分子之间存在间隔,不能体现质量守恒定律,不符合题意;
C、碳与氧气反应生成二氧化碳,反应的化学方程式为:C + O2![]() CO2,每12份质量的碳与32份质量的氧气生成44份的二氧化碳,1.2g碳与3.2g氧气恰好完全反应可生成4.4g二氧化碳,符合题意;
CO2,每12份质量的碳与32份质量的氧气生成44份的二氧化碳,1.2g碳与3.2g氧气恰好完全反应可生成4.4g二氧化碳,符合题意;
D、过氧化氢溶于水,形成过氧化氢溶液,无新物质生成,属于物理变化,不能体现质量守恒定律,不符合题意。
故选C。

练习册系列答案
相关题目
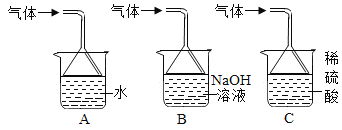
【题目】请从A~C中任选两个作答,若均作答,按前两个计分。
序号 | A | B | C |
实验 装置 |
|
|
|
问题 | 该实验的目的是_____。 | 若用此实验成功验证质量守恒定律,改进的方法是_____。 | 能说明铜具有导热性的现象是_____。 |