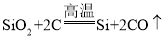题目内容
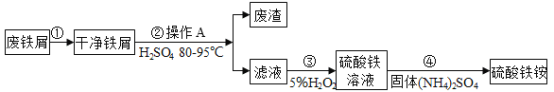
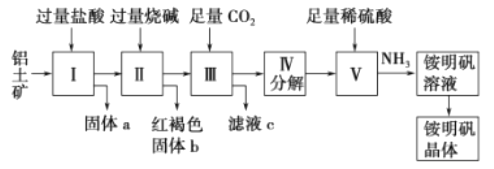
【题目】铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示:(已知氢氧化铝能溶解在氢氧化钠溶液中,生成偏铝酸钠NaAlO2)
请回答下列问题:
(1)固体a的化学式为_____,Ⅲ中通入足量CO2气体能生成氢氧化铝和一种酸式盐。写出发生反应的化学方程式为_____。
(2)IV步分解指加热使氢氧化铝分解为相应的氧化物。由V制取铵明矾溶液的化学方程式为_____,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)_____、冷却结晶、过滤洗涤。
(3)以1000kg含氧化铝30.6%的铝土矿为原料制取Al2(SO4)3,需消耗含溶质质量为_____g的98%的浓硫酸(密度1.84g·cm-1)。
(4)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的“微粒”个数之比为1:1,则投料时铝土矿中的AI2O3和H2SO4的“微粒”个数之比为_____。
【答案】SiO2 ![]()
![]() 蒸发浓缩 900 3:10
蒸发浓缩 900 3:10
【解析】
(1)铝土矿中的Al2O3和Fe2O3都能与盐酸反应,生成溶于水的盐,SiO2不能和盐酸反应,故固体a是SiO2,Al2O3在氢氧化钠溶液中生成NaAlO2,NaAlO2与CO2和水反应,生成碳酸氢钠和氢氧化铝沉淀,化学方程式为![]() ;
;
(2)Al(OH)3受热分解出Al2O3,Al2O3与硫酸和氨气反应生成NH4Al(SO4)2,该反应的化学方程式为:![]() ;从铵明矾溶液中获得铵明矾晶体的操作顺序为蒸发浓缩、冷却结晶、过滤洗涤。
;从铵明矾溶液中获得铵明矾晶体的操作顺序为蒸发浓缩、冷却结晶、过滤洗涤。
(3)可以求出该铝土矿中氧化铝的质量为1000kg×30.6%=306kg,设反应需要的硫酸的质量为![]() ,根据化学方程式可得:
,根据化学方程式可得:
![]()
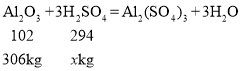
![]() ,需要98%浓盐酸的质量为882kg÷98%=900kg;
,需要98%浓盐酸的质量为882kg÷98%=900kg;
(4)根据制取铵明矾反应的化学方程式![]() 制取硫酸铝的化学方程式
制取硫酸铝的化学方程式![]() ,在制取铵明矾时需要1份氧化铝和4份硫酸,生成2份铵明矾,在制取硫酸铝的反应中,制取2份硫酸铝需要2份氧化铝和6份的硫酸,所以要产生铵明矾和硫酸铝微粒个数相同,则需要3份氧化铝和10份硫酸,氧化铝和硫酸的微粒个数比为3:10.
,在制取铵明矾时需要1份氧化铝和4份硫酸,生成2份铵明矾,在制取硫酸铝的反应中,制取2份硫酸铝需要2份氧化铝和6份的硫酸,所以要产生铵明矾和硫酸铝微粒个数相同,则需要3份氧化铝和10份硫酸,氧化铝和硫酸的微粒个数比为3:10.

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案