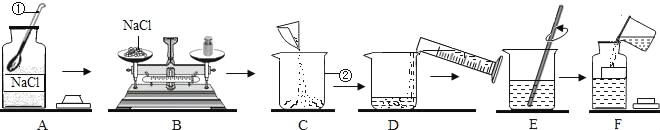
题目内容
【题目】小刚和小敏在探究氢氧化钠性质实验结束后,没有将氢氧化钠固体试剂瓶塞盖好。这样一瓶敞口放置的氢氧化钠固体,激发了同学们的探究欲望。
(提出问题)这瓶氢氧化钠固体是否变质?
氢氧化钠露置在空气中变质的原因是_____________________________(用化学方程式表示)
(提出猜想)
猜想一:没有变质;
猜想二:部分变质;
猜想三:全部变质。
(实验探究)小刚和小敏设计了如下实验方案:
小刚:取少量样品加适量蒸馏水配成溶液后,滴入几滴酚酞溶液,若观察到溶液变红色,证明该瓶氢氧化钠固体没有变质。小敏认为小刚的结论是错误的,理由是___________________________________。
于是小敏进行了如下实验:
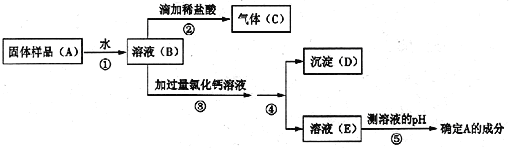
(1)上述实验操作④的名称_______________,其中玻璃棒的作用________________。
(2)步骤③中加过量氯化钙溶液的目的是___________________________________。
(3)步骤⑤中,小敏用洁净干燥的玻璃棒蘸取该溶液滴到湿润的pH试纸上,测得pH=10,他判断猜想二是正确的。对他的操作方法、测量结果及结论的评价,正确的是________。
A 方法正确,结果正确,且结论正确
B 方法正确,结果正确,结论不正确
C 方法不正确,结果偏大,但结论正确
D 方法不正确,结果偏小,但结论正确
(交流反思)
(1)下列物质能替代小敏实验中CaCl2溶液的是____________(填序号)。
①BaCl2溶液 ②Ca(NO3)2溶液 ③Ca(OH) 2溶液 ④Ba(OH)2 溶液
(2)在实验室里氢氧化钠需要密封保存。药品密封保存的原因很多,请你写出浓硫酸需要密封保存的原因____________________________________。
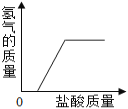
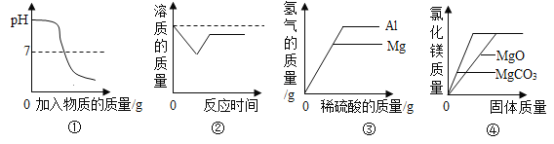
(3)小红对上述固体中Na2CO3的含量产生兴趣,配置了100g溶液进行实验,测定Na2CO3的质量分数。取样,向溶液中逐滴加入稀盐酸至过量,测得生成气体质量与所加稀盐酸质量关系如图所示:
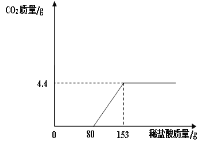
请回答下列问题:
①反应生成的气体质量为________g;
②该溶液中Na2CO3的质量分数。___________
【答案】2NaOH+CO2 ═Na2CO3+H2O 碳酸钠溶液也呈碱性 过滤 引流 除尽碳酸钠,防止干扰 D ①② 浓硫酸具有吸水性 4.4 10.6%
【解析】
[提出问题]氢氧化钠能吸收空气中二氧化碳生成碳酸钠和水而变质;化学方程式为:2NaOH+CO2 ═Na2CO3+H2O;
[实验探究]根据所学知识可以知道,若氢氧化钠变质则会生成碳酸钠,碳酸钠溶液显碱性,也能使酚酞溶液变红,因此小刚同学的实验方案错误;
(1)实验操作④是将沉淀与液体分开,此操作是过滤,玻璃棒的作用是引流;
(2)步骤③中,防止碳酸钠对氢氧化钠检验的影响,可采取加入过量氯化钙溶液的方法把碳酸钠全部转变成沉淀,以检验溶液中是否还含有氢氧化钠,若有氢氧化钠则判断为部分变质;
(3)步骤⑤中,用pH试纸测定未知溶液的pH时,正确的操作方法为用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH.小敏用洁净干燥的玻璃棒蘸取某溶液滴到湿润的pH试纸上,测得pH=10.由于用水湿润pH试纸,稀释了该碱性溶液,溶液的碱性变弱,故小明同学的测定结果偏小;
[交流反思](1)为不影响滴加酚酞对氢氧化钠是否存在的检验,所加入的试剂不应为碱性溶液且不能反应后生成碱性物质,而氢氧化钙、氢氧化钡都呈碱性且能与碳酸钠反应生成氢氧化钠,因此,不能使用③Ca(OH)2溶液、④Ba(OH)2溶液代替氯化钙溶液;
(2)浓硫酸具有吸水性,所以浓硫酸需要密封保存;
(3)①由图象可知,生成二氧化碳的质量为4.4g;
②设生成4.4g二氧化碳需要碳酸钠的质量为x,则:
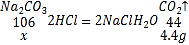
![]()
x=10.6g,
该溶液中Na2CO3的质量分数为:![]() 100%=10.6%;
100%=10.6%;
答:该溶液中Na2CO3的质量分数为10.6%。

【题目】某实验小组的同学用氢氧化钠溶液和稀硫酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液滴加稀硫酸一会儿后,发现忘记了滴加指示剂。此时,他们停止滴加稀硫酸,并对烧杯内溶液中溶质的成分进行探究。Ⅰ.写出该中和反应的化学方程式_________。
Ⅱ.探究烧杯内溶液中溶质的成分:
【提出问题】该烧杯内溶液中溶质是什么?
【进行猜想】
猜想一:可能是Na2SO4与NaOH;猜想二:可能只是Na2SO4;猜想三:可能是_________。
【查阅资料】Na2SO4溶液呈中性。
【实验探究】
实验步骤 | 实验现象 | 实验结论 |
(1)取少量烧杯内溶液于试管中,滴入几滴酚酞溶液,振荡 | _________ | 猜想一不正确 |
(2)取少量烧杯内溶液于另一支试管中,滴加碳酸钠溶液 | _________ | 猜想二不正确,猜想三正确 |
【反思与拓展】
(1)探究猜想三成立,除以上方案外,下列哪些物质也能完成该实验?_________(填序号)
A.pH试纸 B.铜 C.氧化铜 D.氢氧化铜
(2)甲、乙两位同学准备测定反应后溶液中H2SO4的质量分数。
①甲同学取50g该溶液于烧杯中,逐滴滴入溶质质量分数为10%的NaOH溶液,反应过程中溶液的pH变化如右图所示,求溶液中H2SO4的质量分数_________。(写出计算过程)
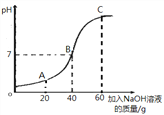
②试写出A点溶液中的溶质_________。
③乙同学改用BaCl2溶液代替NaOH溶液,根据生成沉淀的质量来确定溶液中H2SO4的质量分数,你认为结果将_______(填“偏大”“偏小”或“无影响”)。