��Ŀ����
����Ŀ��ˮ��������ԴȪ��Ҳ�Dz���ȱ�ٵ���Դ��
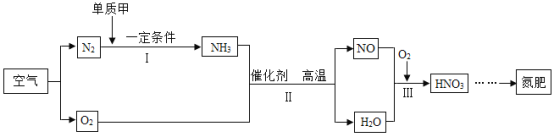
��1����Լ��ˮ��ÿ���������������Ӧ���ᳫ���·�ʽ�е�_____������ĸ����
A ����ࡢ�ι�ķ�������ũ����� B ����ϵط�ˮϴ�·�
C �����ܽ�ˮ��ͷ������ˮ�϶�ľ�ʽ��ͷ D ������ˮ��ϴ��ˮ�����������
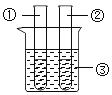
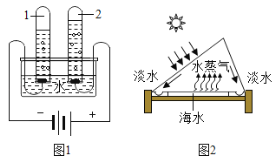
��2������ͬѧ�ռ���һƿ���ǵĺ�ˮ����ģ������ˮ���ľ�ˮ���̣������Ƴ�����ˮ��ʵ�������ͼ��ʾ����ش�
��������������_____���ò�����ʹ�õIJ���������_____������һ�֣�������������_____����������ȥҺ��C�е�ɫ�غ���ζ��
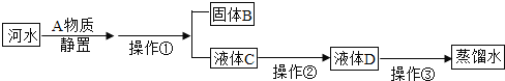
��3����ͼ1Ϊ���ˮʵ���ʾ��ͼ�� ͼ2Ϊ̫���ܺ�ˮ����װ��ʾ��ͼ��
��ͼ1ʵ���з�Ӧ�����ֱ���ʽΪ_____���Թ�1�в�����������_____��д���ƣ���
����ͼ2װ����ȡ��ˮ������Դ�Ƕȷ������������ŵ���_____��
��4��ȡ������ˮ������һ�����ķ���ˮ����������_____��˵����ˮΪӲˮ����ͥ����������Ӳˮ����÷�����_____��
���𰸡�ACD ���� ����������©�����ձ��� ����̿ ˮ![]() ����+���� ���� ���ܣ�ʹ��̫���ܽ��ܻ����� �϶�ĸ��� ���
����+���� ���� ���ܣ�ʹ��̫���ܽ��ܻ����� �϶�ĸ��� ���
��������
��1��A������ࡢ�ι�ķ�������ũ����֣��ܽ�Լ��ˮ��Ӧ���ᳫ��
B������ϵط�ˮϴ�·��������ˮ���˷ѣ���Ӧ���ᳫ��
C�������ܽ�ˮ��ͷ������ˮ�϶�ľ�ʽ��ͷ���ܽ�Լ��ˮ��Ӧ���ᳫ��
D��������ˮ��ϴ��ˮ�������������һˮ���ã��ܽ�Լ��ˮ��Ӧ���ᳫ��
��2���������ܽ���Һ�ֿ��������ǹ��ˣ��ò�����ʹ�õIJ��������в�������©�����ձ�������̿�����������ԣ������ڳ��û���̿����������ȥҺ��C�е�ɫ�غ���ζ��
��3����ͼ1ʵ���ǵ��ˮ��������������������Ӧ�����ֱ���ʽΪ��ˮ![]() ����+�������Թ�1�в����������ǵ�Դ�ĸ���������������������
����+�������Թ�1�в����������ǵ�Դ�ĸ���������������������
����ͼ2װ����ȡ��ˮ��������̫���ܵ�����ˮ������Դ�Ƕȷ������������ŵ��ǽ��ܣ�ʹ��̫���ܽ��ܻ�������
��4��ȡ������ˮ������һ�����ķ���ˮ���������ֽ϶ม����˵����ˮΪӲˮ����ͥ����������Ӳˮ����÷�������С�
�ʴ�Ϊ����1��ACD����2�����ˣ�����������©�����ձ���������̿����3����ˮ![]() ����+���������� �ڽ��ܣ�ʹ��̫���ܽ��ܻ���������4���϶�ĸ�������С�
����+���������� �ڽ��ܣ�ʹ��̫���ܽ��ܻ���������4���϶�ĸ�������С�

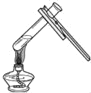
����Ŀ��ʵ���ҳ��ø��������ȡ�����������õ���װ����ͼ��ʾ��

��1����ʵ���ѡ�õķ������ռ�װ��Ϊ________������ĸ����
��2��ȡһ�����ĸ�����ع��壬��ּ��ȣ�����ʵ�ʲ���������Զ��������ֵ������ܵ�ԭ����________���ⶨ�����в��������ɺ��ԣ���
��3��ijͬѧ���и�ʵ�鲢����ˮ���ռ�O2�����в�����ȷ����__������ĸ��
A δ���װ�������Լ�����Թ��м��������ع���
B �����ܿ����������ݾ���ð��ʱ����ʼ�ռ�����
C ����ƿ�������ռ��������ò���Ƭ��ס����ƿ�ڣ��ٽ����Ƴ�ˮ��
D �����ռ���Ϻ���Ϩ��ƾ��ƣ��ٽ������Ƴ�ˮ��
��4��ʵ����Ҳ����˫��ˮ��������ijͬѧΪ�о�MnO2��ĩ������˫��ˮ�ֽ����ʵ�Ӱ�죬��������ʵ�飺���ò�ͬ������MnO2��ĩ��������ÿ�ξ���30mL 10%��˫��ˮ������ʵ����������ͬ�����ⶨ�ռ�500mL�������õ�ʱ�䣬��������
��� | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
MnO2����/g | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 | 0.9 |
����ʱ��/s | 17 | 8 | 6 | 3 | 2 | 2 | 2 | 2 | 2 |
��д��������Ӧ�ķ��ű���ʽ�� ________���÷�Ӧ�Ļ���������__________��
�ڸ�ʵ��ɵó��Ľ�����______________��
��������ʵ��ѡ��B������װ�ã�Ҳ������ȡ������©���¶˹ܿڱ����û��Һ���У�ԭ����_______����ѡ��C������װ�ã�����Ϊѡ��װ��C���ŵ���____________��
����ʵ����Ҳ���Խ�ע�������ӵ�װ��B�ĵ��ܿڴ�������_________��
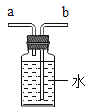
��5��ʵ�����������������壬���ü�����ˮ���������ʯ�����ֹ��������Ƶá��Ƽ�������ķ���װ��Ӧѡ��________������ĸ��װ�ã��ռ���������ѡ��E��Fװ�ã��ɴ��ƶϼ��������е�����������_____________��������ͼװ���ռ��ü��飬������______��ͨ�루����a������b����
��6����ʵ��������ȡ�������ȿɲ��÷ֽ��������ķ�����Ҳ�ɲ��÷ֽ�����صķ������������ַ�������Ҫ��ͬ����___________��
�ٲ���MnO2���ɸı��䷴Ӧ���� �ڷ�Ӧ���������
�۶����ú������ʵķֽ����ﵽĿ�� �����ַ�������������ͬ��
A �٢� B �� �� C �٢� D �ڢ�
��7��ijͬѧ��ѧϰ��MnO2��H2O2�ķֽ�Ĵ�����֮�Դ���������Ũ�����Ȥ�����ǣ�������±���ʾʵ�飬̽������ͭ��H2O2�ֽ����ʵ�Ӱ�졣
�� �� | װ �� | �� �� |
1��ȡһ��ͭ˿��������Ͳ�Σ��̶�����˿�ϡ� |
| |
2���ֱ���ٺ͢���ע��15mL��30%��H2O2��Һ��������ʢ����ˮ�Ģ��С� |
| Լ1min��ɹ۲쵽�ٺ͢��ж����������ݲ����� |
3����ͭ˿��������С� |
| �����д������ݲ�����5min���������ݲ�������ʱ������Ȼ�������������ݲ����� |
�ش��������⣺
��a����������ʵ���е�Ŀ����_____________
��b���ܷ���Եó�ͭ���Լӿ�H2O2�ֽ������_______��������������������������_______��
��c�����������ʵ��̽��ͭ�Dz���H2O2�ֽ�Ĵ�������Ҫ������ʵ�鷽�����в��䣬���б�Ҫ����_____��
A ����ʵ��ǰͭ˿������������ʵ����ͭ˿���������
B ������������������
C ��ʵ����ͭ˿������AgNO3��Һ�У���֪ͭ���Ժ�AgNO3��Һ��Ӧ��������ɫ���壩
D ����˿����ͭ˿
E ������������Һϡ��
��d����ͬѧ�������ϵ�֪��CuO��CuSO4�����Ρ���������Ҳ����������������Һ�ֽ�Ĵ����������йش�����˵������ȷ����___________��
A MnO2ֻ��������������Һ�ֽ�Ĵ���
B ͬһ����ѧ��Ӧ�����ж��ִ���
C ����ֻ�ܼӿ컯ѧ��Ӧ������
D �������������ʲ�������������Ӧ�ķ�Ӧ���������
����Ŀ��ij��ȤС��ͬѧ��ʵ�����Ʊ�������������������̽��ʵ�顣
��������⣩����ͭ�Ƿ�Ҳ��������طֽ�Ĵ�����
����Ʋ����ʵ�飩
������3.0g����ط����Թ��м���
������3.0g�������1.0g�������̾��Ȼ�ϼ���
������xg�������1.0g����ͭ���Ȼ�ϼ���
��ʵ���������������x��ֵӦΪ_____����ʵ���������ȽϿ�֤��_____����ʵ������Ӧ��Ĺ����ˮ�ܽ⡢���ˡ�ϴ�ӡ�����������õ�1.0g��ɫ��ĩ���ٽ���ɫ��ĩ��xg����ػ�ϼ��ȣ�������ʵ������ͬ���˲�����Ϊ��֤������ͭ�ڸû�ѧ��Ӧǰ��_____��_____�����䡣
������1������ͭҲ��������طֽ�Ĵ�������д��ʵ�����еĻ�ѧ��Ӧ���ֱ���ʽ_____��
������̽����С��ͬѧ�������ʵ�������һ������������ͭ������һ�����������
��ȡ������Ӧ���ʹ�ϵ����̽�����±������ǵ��й�ʵ�����ݣ�����ش��й����⣺
����ͭ������ص������� | 1/40 | 1/20 | 1/10 | 1/5 | 1/3 | 1/2 | 2/3 | 1/1 | 2/1 |
����1L���������ʱ�䣨s�� | 124 | 79 | 50 | 54 | 75 | 93 | 106 | 153 | 240 |
���������������ϱ���֪����ͭ�������࣬��������������_____���������������������������������������ͭ������ص�������Ϊ_____ʱ����Ӧ������졣
������2���ڻ�ѧ��Ӧ�д���������_____����������������������Խ��Խ�á�
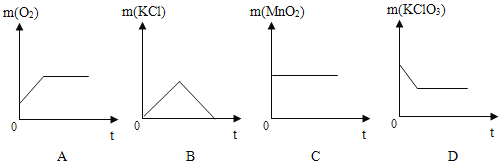
��������������һ��������������м�������������ͭ�����ȵ����ٲ�������Ϊֹ����ͼ������ȷ��ʾ��Ӧǰ������ʵ������仯��m����ʱ�䣨t����ϵ����_____��
��������⣩��˫��ˮ�ֽ��ٶȻ���ʲô�����йء�
����Ʋ����ʵ�飩
˫��ˮ������ | ˫��ˮ��Ũ�� | MnO2������ | ��ͬʱ���ڲ�������O2��� | |
�� | 50.0g | 1% | 0.1g | 9mL |
�� | 50.0g | 2% | 0.1g | 16mL |
�� | 50.0g | 4% | 0.1g | 31mL |
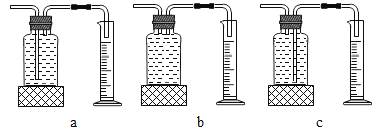
��ʵ���У�����O2�����װ����_____�����ţ���
������3������ͬ�����£�˫��ˮ��_____��˫��ˮ�ֽ��Խ�졣