题目内容
某同学为了检验家里购买的硫酸铵化肥是否合格,称取了27.5 g化肥样品与足量浓烧碱溶液一起加热,产生的氨气用足量的100.0 g废硫酸吸收,测得吸收氨气后的溶液总质量为106.8 g,已知合格硫酸铵化肥中含氮量不低于20%。所涉及的反应为:(NH4)2SO4+2NaOH Na2SO4+2NH3↑+2H2O,
Na2SO4+2NH3↑+2H2O,
2NH3+H2SO4=(NH4)2SO4。试计算:
(1)化肥样品完全反应后产生氨气_________g。
(2)该化肥的含氮量为____________(精确到0.1%),属于_____________(填“合格”或“不合格”)产品。
 Na2SO4+2NH3↑+2H2O,
Na2SO4+2NH3↑+2H2O,2NH3+H2SO4=(NH4)2SO4。试计算:
(1)化肥样品完全反应后产生氨气_________g。
(2)该化肥的含氮量为____________(精确到0.1%),属于_____________(填“合格”或“不合格”)产品。
(1)6.8 (2)20.4% 合格
根据质量守恒定律,废硫酸溶液增加的质量即为生成氨气的质量:106.8 g-100.0 g="6.8" g;由化学方程式知硫酸铵中的氮元素全部转化到氨气中,氨气中的氮元素质量即为样品中氮元素质量,所以该化肥的含氮量为:(6.8 g×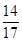 )÷27.5 g×100%≈20.4%>20%,所以是合格产品。
)÷27.5 g×100%≈20.4%>20%,所以是合格产品。
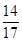 )÷27.5 g×100%≈20.4%>20%,所以是合格产品。
)÷27.5 g×100%≈20.4%>20%,所以是合格产品。
练习册系列答案
相关题目

 C6H12O7+Cu2O↓+2H2O
C6H12O7+Cu2O↓+2H2O 


