题目内容
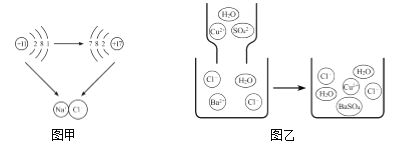
【题目】通过学习了酸的通性,我们可以对硫酸的化学性质进行验证和总结,下图所示“—”表示物质两两之间能发生化学反应。请根据下图,回答问题。

(1)浓硫酸能使纸张变黑是因为它有_____性,在稀释浓硫酸时要将_____,并不断搅拌。
(2)紫色石蕊试液遇硫酸呈_____色。
(3)补充一个实验,完善硫酸的化学性质,X可以是_____(用化学式表示),它的物质类别是_____(填“单质”、“氧化物”、“酸”、“碱”或“盐”)。
(4)请写出氢氧化铁与硫酸反应的化学方程式_____,该反应的现象是_____。
(5)为测定某硫酸中溶质的质量分数,甲同学取该硫酸样品50g,向其中加入过量锌粒,充分反应后收集到0.4克氢气,请完成下列计算与
Ⅰ.收集到的氢气是:_____mol;
Ⅱ.该硫酸中溶质的质量分数。_____(根据化学方程式计算)。
【答案】脱水 浓硫酸沿器壁慢慢注入水中 红 Na2CO3 盐 ![]() 红褐色固体逐渐溶解,溶液由无色变为黄色 0.2 39.2%
红褐色固体逐渐溶解,溶液由无色变为黄色 0.2 39.2%
【解析】
(1)浓硫酸能使纸张变黑是因为它有脱水性,在稀释浓硫酸时要将浓硫酸沿器皿慢慢注入水中,并不断搅拌;
(2)硫酸显酸性,故紫色石蕊试液遇硫酸呈红色;
(3)碳酸钠能与硫酸反应生成硫酸钠和水,故X可能是碳酸钠,化学式为:Na2CO3,碳酸钠属于盐;
(4)氢氧化铁与硫酸反应生成硫酸铁和水,该反应的化学方程式为:![]() ;该反应的现象是:红褐色固体逐渐溶解,溶液由无色变为黄色;
;该反应的现象是:红褐色固体逐渐溶解,溶液由无色变为黄色;
(5)Ⅰ收集到的氢气是:![]() ;
;
Ⅱ解:设该硫酸中溶质的质量分数是x
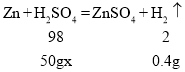
![]()
x=39.2%
答:该硫酸中溶质的质量分数为39.2%。

 全能测控一本好卷系列答案
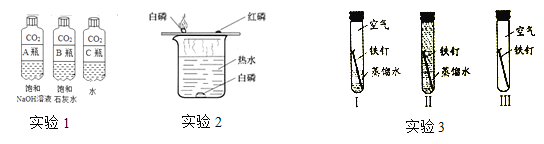
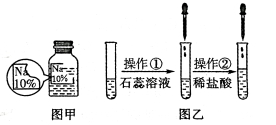
全能测控一本好卷系列答案【题目】(7分)某同学在实验室发现了一瓶标签残缺的无色溶液﹙如图甲所示﹚,为确认其中的溶质,他设计并进行了如下探究活动,请回答下列问题。
【猜想与假设】其溶质可能为NaCl、NaOH、Na2CO3和NaHCO3中的一种。
【资料查阅】上述四种物质的相关信息如下:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
常温下的溶解度/g | 36 | 109 | 21.5 | 9.6 |
常温下某稀溶液的pH | 7 | 13 | 11 | 9 |
【探究过程】
如图乙所示,在操作①后可确定溶质不是NaCl,则其实验现象应是 ;
在进行操作②时有无色无味得到气体产生,由此又可排除假设物质中的 。
【探究结论】
你认为该溶液中的溶质可能是上述假设物质中的 ,你的判断依据是 。
【探究反思】
(1)若上述探究结论是正确的,操作②产生的气体应是 (写化学式),实验室检验该气体的实验操作及现象是 。
(2)另有同学猜想其中的溶质还可能是Na2SO4,但又没有Na2SO4的上述表列信息。
请你根据以上实验操作的相关现象,判断该溶液中的溶质是否是Na2SO4,并叙述理由: 。