题目内容
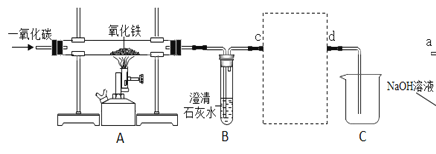
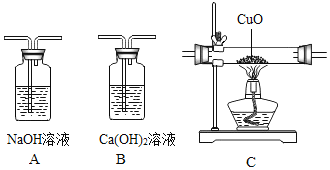
【题目】某兴趣小组利用如图装罝(省略夹持仪器)探究二氧化碳与氢氧化钠溶液的反应

(实验步骤)
①将足量的氢氧化钠浓溶液装入分液漏斗中。
②打开止水夹K1,待氢氧化钠浓溶液完全进入广口瓶之后立即关闭K2。
③待充分反应后,打开止水夹K2
(实验现象)
整个实验过程中,观察到注射器中的液体_____。U型管中_____,广口瓶中的液体出现浑浊。
(实验解释)
步骤②中发生反应的化学方程式为_____。产生上述现象的原因_____。
【答案】液体自动喷出或自动喷入U型管或进入U型管 液体变红,并有部分液体沿导管进入广口瓶(有液体进入即给分) CO2+2NaOH=Na2CO3+H2O 二氧化碳与氢氧化钠反应生成碳酸钠,广口瓶中气压变小,流入瓶中的氢氧化钙与碳酸钠反应产生碳酸钙白色沉淀,此时U型管右侧气压也变小,使注射器中液体自动喷出,酚酞溶液遇碱性氢氧化钙溶液变为红色
【解析】
实验现象:
氢氧化钠浓溶液和二氧化碳反应生成碳酸钠和水,化学方程式为:![]() ;气体被消耗,瓶内压强减小,U型管左侧的液体有部分液体沿导管进入广口瓶;由于U型管左侧的液体有部分液体沿导管进入广口瓶,导致U型管中右侧空气中压强减小,从而大气压将压注射器,造成注射器中的液体自动喷出,碱溶液能使无色酚酞变红;广口瓶中出现浑浊现象的原因二氧化碳与氢氧化钠反应生成的碳酸钠与氢氧化钙反应产生碳酸钙白色沉淀;
;气体被消耗,瓶内压强减小,U型管左侧的液体有部分液体沿导管进入广口瓶;由于U型管左侧的液体有部分液体沿导管进入广口瓶,导致U型管中右侧空气中压强减小,从而大气压将压注射器,造成注射器中的液体自动喷出,碱溶液能使无色酚酞变红;广口瓶中出现浑浊现象的原因二氧化碳与氢氧化钠反应生成的碳酸钠与氢氧化钙反应产生碳酸钙白色沉淀;
故整个实验过程中,观察到注射器中的液体液体自动喷出或自动喷入U型管或进入U型管;U型管中液体变红,并有部分液体沿导管进入广口瓶,广口瓶中的液体出现浑浊。
实验解释:
步骤②中,氢氧化钠浓溶液和二氧化碳反应生成碳酸钠和水,化学方程式为:![]() 。
。
产生上述现象的原因是:二氧化碳与氢氧化钠反应生成碳酸钠,广口瓶中气压变小,流入瓶中的氢氧化钙与碳酸钠反应产生碳酸钙白色沉淀,此时U型管右侧气压也变小,使注射器中液体自动喷出,酚酞溶液遇碱性氢氧化钙溶液变为红色。

【题目】某化学兴趣小组的同学在实验室发现一瓶敞口放置的过氧化钠(Na2O2)固体,他们对该固体是否变质产生了兴趣,对固体成分进行了实验探究。
(查阅资料)
①在标准状况下,氧气的密度是1.429g/L.在室温下,1L水中能溶解约30mL的氧气。
②过氧化钠能与二氧化碳反应:2Na2O2+2CO2═2Na2CO3+O2↑
③过氧化钠能与水反应:2Na2O2+2H2O═4NaOH+O2↑
④BaCl2溶液呈中性。
(成分猜想)固体中可能有Na2O2、NaOH和Na2CO3中的一种或几种。
(实验验证)
实验步骤 | 实验现象 | 结论或化学方程式 |
(1)取少量样品于试管中,加水溶解,并立即将带火星的木条伸入试管中。 | 有气泡产生,_______ | 证明固体中含有Na2O2 |
取步骤(1)所得溶液于试管中,滴加过量的BaCl2溶液 | 有白色沉淀生成 | 证明固体中含有Na2CO3,化学方程式为_______ |
取步骤(2)中的上层清液于试管中,滴入1~2滴酚酞试液 | 溶液变红 | 证明固体中含有NaOH. |
(分析交流)经过讨论分析,同学们认为步骤(3)中的结论不合理,不能证明固体中含有NaOH,理由是_______。
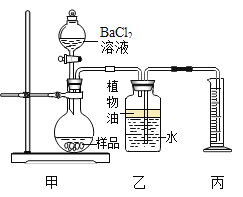
(继续探究)为确定固体中是否含有NaOH,取一定质量的样品,利用如图装置进行实验验证。(BaCl2溶液的体积和温度变化对气体体积的影响忽略不计)
(1)装置乙中植物油的作用是_______。
(2)待反应完全后,根据收集所得气体的体积,进行相关计算,得出样品中_______的质量。
(3)再将烧瓶中的沉淀进行过滤、洗涤、烘干、称量,进行相关计算,得出样品中_______的质量。
(实验结论)经过实验数据分析,得出固体中不但含有Na2O2和Na2CO3,还含有NaOH.证明含有NaOH的依据是_______。