题目内容
【题目】某化学兴趣小组对![]() 、
、![]() (钛)、
(钛)、![]() 三种金属的金属活动性进行探究。
三种金属的金属活动性进行探究。
提出假设:a.![]() 金属活动性比
金属活动性比![]() 强;b.
强;b.![]() 金属活动性比
金属活动性比![]() 强。
强。
查阅资料:在相同条件下,金属与酸反应,产生气泡的速度越快,则该金属活动性越强。
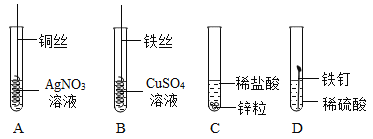
实验设计:同温下,取质量相同的这三种金属薄片,分别投入等体积等浓度的足量的稀盐酸中反应,观察现象。请回答下列问题。
(1)三种金属加入盐酸前都先用砂纸将表面擦光亮,其目的是________(填序号)。
A除去氧化膜,有利于直接反应 B使表面不平整,易反应
C使表面光亮,易观察现象 D使反应金属温度相同,易反应
(2)填写下表中的有关现象和结论。
金属 | Ti | Mg | Cu |
与盐酸反应现象 | 放出气泡速度缓慢 | 放出气泡速度快 | ______ |
结论 | 原假设中______(选填“a“b”或“a、b”)不正确,理由是:______;三种金属的活动性顺序为_____ | ||
【答案】A 没有气泡放出 a ![]() 与酸反应放出气泡速度比
与酸反应放出气泡速度比![]() 快
快 ![]()
【解析】
(1)金属在空气中易发生缓慢氧化,表面有氧化物,所以在实验前用砂纸将表面擦光亮,有利于反应。
(2)铜在金属活动性顺序中排在氢的后面,不与稀盐反应,所以不产生气泡。
(3)钛与盐酸反应放出气泡速度缓慢,而镁与盐酸反应放出气泡速度快,所以镁的活动性比钛的强,原假设中a不正确。镁和钛与盐酸反应,而铜不与盐酸反应,所以三种金属的活动性顺序为![]() 。
。

练习册系列答案
相关题目