题目内容
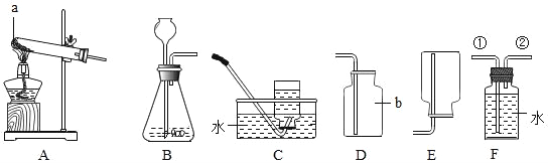
【题目】如图是实验室制取氧气和二氧化碳的装置,请根据装置回答问题。

(1)用装置A制取氧气的化学方程式为___________________。
(2)用装置B制取二氧化碳,验满的方法是_______________。
【答案】![]() 将燃着的木条放在集气瓶瓶口,如果木条立即熄灭,证明二氧化碳已收集满
将燃着的木条放在集气瓶瓶口,如果木条立即熄灭,证明二氧化碳已收集满
【解析】
(1)装置A是固体在加热的条件下反应制取氧气,试管口有一团棉花,所用的药品是高锰酸钾,也就是高锰酸钾加热生成锰酸钾、二氧化锰和氧气,反应的化学方程式是![]() ;
;
故填:![]() 。
。
(2)用装置B制取二氧化碳,采用的是向上排空气法,验满的方法是:将燃着的木条放在集气瓶瓶口,如果木条熄灭,证明二氧化碳已收集满;
故填:将燃着的木条放在集气瓶瓶口,如果木条熄灭,证明二氧化碳已收集满。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】某化学兴趣小组对![]() 、
、![]() (钛)、
(钛)、![]() 三种金属的金属活动性进行探究。
三种金属的金属活动性进行探究。
提出假设:a.![]() 金属活动性比
金属活动性比![]() 强;b.
强;b.![]() 金属活动性比
金属活动性比![]() 强。
强。
查阅资料:在相同条件下,金属与酸反应,产生气泡的速度越快,则该金属活动性越强。
实验设计:同温下,取质量相同的这三种金属薄片,分别投入等体积等浓度的足量的稀盐酸中反应,观察现象。请回答下列问题。
(1)三种金属加入盐酸前都先用砂纸将表面擦光亮,其目的是________(填序号)。
A除去氧化膜,有利于直接反应 B使表面不平整,易反应
C使表面光亮,易观察现象 D使反应金属温度相同,易反应
(2)填写下表中的有关现象和结论。
金属 | Ti | Mg | Cu |
与盐酸反应现象 | 放出气泡速度缓慢 | 放出气泡速度快 | ______ |
结论 | 原假设中______(选填“a“b”或“a、b”)不正确,理由是:______;三种金属的活动性顺序为_____ | ||
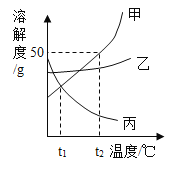
【题目】20℃时,向下列3只盛有100g水的烧杯中,分别加入40g三种固体,充分溶解。
温度/℃ | NaCl | KNO3 | NaNO3 |
20 | 36.0g | 31.6g | 88g |
60 | 37.3g | 110g | 125g |

将三份溶液升温至60℃,下列说法正确的是()
A.①②③的溶质质量分数都发生改变
B.①②③都变成不饱和溶液
C.②中溶质和溶剂的质量比为2:5
D.溶液质量②<③
【题目】某化学兴趣小组将光亮铜片放在酒精灯火焰上灼烧,发现表面变黑,他们对黑色物质的成分产生了兴趣,铜片表面的黑色物质是什么呢?
(查阅资料)
(1)酒精不充分燃烧产生炭黑(即黑烟);
(2)氧气的化学性质比较活泼,加热条件下能与金属铜反应生成黑色的氧化铜。
(3)氧化铜能与稀硫酸反应生成硫酸铜和水;炭黑难溶于水,且与稀硫酸不发生反应。
(猜想与假设)
猜想1:黑色物质是炭黑。
猜想2:黑色物质是空气中的氧气与铜反应生成的氧化铜。
猜想3:黑色物质既有炭黑又有氧化铜。
(进行实验)
实验步骤 | 实验现象 |
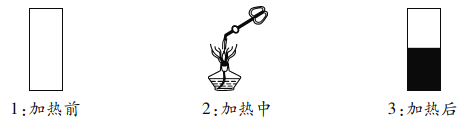
实验一:取一小段光亮铜片,放入试管内,然后用试管夹夹持试管,放在酒精灯的外焰部位加热 | 铜片变黑 |
实验二:取一支试管,将一小段光亮铜片放入试管中,塞上胶塞,并用注射器抽出试管内的空气,封好胶塞,并加热,趁热取下胶塞,观察现象 | 打开胶塞前铜片不变黑;打开胶塞后铜片变黑 |
实验三:将在酒精灯火焰上灼烧后的附着黑色物质的铜片,投入到盛有足量稀硫酸的试管中 | 试管中没有黑色物质剩余,溶液由无色变为蓝色 |
(解释与结论)
(1)由实验可知,猜想________成立。
(2)实验二用注射器抽出试管内空气的目的是_________。
(3)通过对黑色物质来源的探究,金属铜与氧气反应的化学方程式是_________
(4)通过实验一和实验三都能得出猜想1和猜想3不正确,两个实验是从两个角度进行设计实验方案的,实验一是从____________的角度探究;实验三是从_____________的角度探究。
(反思拓展)
(5)实验一为什么能将猜想1和猜想3同时排除呢?你认为依据是_____________________。
【题目】理科实验操作考试中,小明同学在做铝和稀盐酸反应时无意中加入几滴硫酸铜溶液,发现铝片表面产生气泡速率明显增快,对此他产生了兴趣。
(提出问题)硫酸铜溶液是不是此反应的催化剂?硫酸铜溶液的体积对此实验有影响吗?
(设计并实验)室温下,小明将过量、表面积相同已打磨的铝片分别加入到6份30mL10%稀盐酸中,并在每份中加入不同体积的硫酸铜饱和溶液,记录获得相同体积氢气的时间,从而确定产生氢气的速率。
实验混合溶液 | 1 | 2 | 3 | 4 | 5 | 6 |
饱和硫酸铜溶液/mL | 0 | 0.5 | 2.5 | 5 | 10 | 20 |
水/mL | 20 | 19.5 | 17.5 | V | 10 | 0 |
(1)如表表格中V=____________;
(2)写出铝和稀盐酸反应的化学方程式____________:
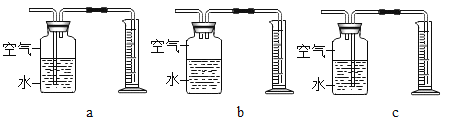
(3)定量收集氢气体积可用如图____________(填写字母序号)装置。
(实验现象)随着硫酸铜溶液体积的增加,产生氢气的速率先加快后明显减慢,且铝片表面附着的红色物质逐渐增加。
(结论与解释)
(4)随着硫酸铜体积的增加,反应速率明显变慢可能的原因是____________;
(5)根据实验现象小明认为硫酸铜溶液不是此反应的催化剂,其原因是____________;
(实验反思)加速铝和稀硫酸反应速率还可以采取的措施是(写出一点)____________
(若正确回答下列小题奖励4分,化学试卷不超过60分)
(实验拓展)根据上述实验,小明认为是盐中的金属离子影响了铝和稀盐酸的反应速率;为了研究不同金属离子对反应的影响,小明同学继续实验,取过量表面积相同的铝片和30mL10%稀盐酸混合后加入不同的盐溶液,实验现象如表(加号越多,代表反应速率越快):
实验1 | 实验2 | 实验3 | 实验4 | 实验5 | |
加入试剂0.5mL | 水 | 5%NaCl溶液 | 5%Mg(NO3)2溶液 | 5%FeSO4溶液 | 5%CuSO4溶液 |
产生气泡速率 | + | + | + | ++ | +++ |
(6)如表中,用水进行实验的目的___;
(7)上述实验设计存有缺陷,该缺陷是___;实验改进后,任符合上表中的实验现象,可得到的实验结论是:①____________;②____________.