题目内容
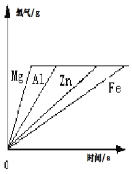
【题目】如图为四种等质量金属与一定量酸反应生成氢气质量与反应时间的关系,请回答下列问题:
⑴金属铝与稀硫酸反应的化学方程式为________________。
⑵反应结束发现有一种金属没有剩余,它是_________。
而在所剩金属中质量最多的是__________ 。
⑶据图可知,它们所所消耗酸的质量应______________。
⑷在硝酸铜与硝酸亚铁的混合溶液中加入一定量的锌粉,充分反应后过滤,所得溶液呈浅绿色;向所得滤渣中加稀盐酸有气泡产生。
A.过滤后滤渣中一定存在的物质是______________。
B.滤液里一定有的溶质是_________________。加入锌粉首先发生的反应化学方程式为:________
【答案】2Al +3H2SO4 = Al2(SO4)3 +3 H2↑ Zn; Al 相等 铜、铁; 硝酸锌和硝酸亚铁; Zn +Cu(NO3)2 = Cu + Zn(NO3)2
【解析】
(1)金属铝与稀硫酸反应生成硫酸铝和氢气,故化学方程式写为2Al +3H2SO4 = Al2(SO4)3 +3H2↑。(2)由图可知,四种金属与酸反应后生成氢气的质量相同。用锌、铁、镁和铝四种金属与酸反应生成等质量的氢气时,消耗四种金属的质量由多到少的顺序是锌>铁.镁>铝。题目中四种金属质量相同,所以反应后没有剩余的故填Zn,剩余质量最多的故填Al。(3)由图可知,四种金属与酸反应后生成的氢气质量相同,根据质量守恒定律,组成氢气的氢元素来自于反应前的酸,所以四种金属消耗的酸的质量是相同的,故填相等;(4)铁、锌、铜三者的金属活动性顺序为锌>铁>铜,硝酸亚铁,硝酸铜的混合溶液中加入一定质量的锌粉时,锌先置换金属活动性最弱的金属铜,然后再置换较强的铁,反应后过滤,所得溶液呈浅绿色说明溶液中还有硝酸亚铁剩余,锌则完全反应完了没有剩余。向所得滤渣中加稀盐酸有气泡产生,表明滤渣中含有铁,所以滤渣中一定有铜和铁,故填铜、铁;综上分析可知锌与全部的硝酸铜和一部分硝酸亚铁发生了置换反应,滤液中的溶质应该是硝酸锌和硝酸亚铁,故填硝酸锌和硝酸亚铁;铁、锌、铜三者的金属活动性顺序为锌>铁>铜,硝酸亚铁,硝酸铜的混合溶液中加入一定质量的锌粉时,锌先置换金属活动性最弱的金属铜,然后再置换活动性较强的铁,所以锌首先和硝酸铜反应,故化学方程式写为Zn +Cu(NO3)2 = Cu + Zn(NO3)2。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下表是空气中的气体成分和人体呼出的气体成分含量对照表:
气体成分 | 氮气 | 氧气 | 二氧化碳 | 水 | 其他气体 |
空气中的气体(﹪) | 78 | 21 | 0.03 | 0.07 | 0.9 |
呼出的气体(﹪) | 78 | 16 | 4 | 1.1 | 0.9 |
某校研究性学习小组的同学设计了简单的实验方案,验证呼出的气体与吸入的气体成分的含量有什么不同,其四个主要操作步骤如图(1、2、3、4)所示,请依据图示将主要实验操作步骤及验证依据填入下表中的空白处:
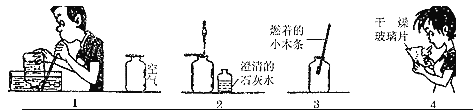
实验步骤 | 验证依据 |
1、用排水法收集两瓶呼出的气体,另收集两瓶空气。 | |
2、将澄清石灰水分别滴入盛有呼出的气体和空气的集气瓶中。 | 根据______________,判断二氧化碳含量不同。 |
3、_______________ | 根据木条燃烧情况的不同,判断氧气含量不同。 |
4、_______________ | 根据______________,判断水含量不同。 |