题目内容
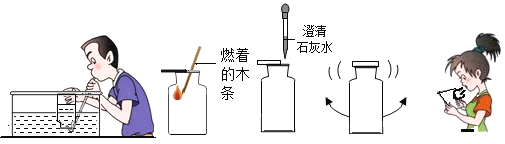
【题目】用如图所示实验探究金属的化学性质。
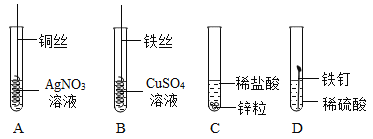
(1)A中实验现象是____________。
(2)若要证明Cu、Fe、Ag的金属活动性顺序,应做的实验是___________(填序号)。
(3)C、D实验中,不能用观察反应速率的方法证明其活动性的原因是___________。
【答案】铜丝表面附着一层固体,溶液由无色变为蓝色 A、B C、D两实验中所用酸的种类及金属的形状、大小均不同
【解析】
(1)由于在金属活动性顺序中铜的金属活动性强于银,所以铜能与硝酸银发生置换反应生成硝酸铜和银,故可观察到铜丝表面附着一层固体,溶液由无色变为蓝色;
(2)用于证明Cu、Fe、Ag的金属活动性顺序实验是A、B,因为由A可知铜能置换出硝酸银中的银,说明活动性铜>银,B中的铁能置换出硫酸铜中的铜,说明活动性铁>铜,所以可得出三种金属的金属活动性顺序;
(3)C、D两组实验中所用酸的种类及金属的形状、大小均不同,所以不能用观察反应速率的方法证明其金属活动性。

【题目】某化学兴趣小组对![]() 、
、![]() (钛)、
(钛)、![]() 三种金属的金属活动性进行探究。
三种金属的金属活动性进行探究。
提出假设:a.![]() 金属活动性比
金属活动性比![]() 强;b.
强;b.![]() 金属活动性比
金属活动性比![]() 强。
强。
查阅资料:在相同条件下,金属与酸反应,产生气泡的速度越快,则该金属活动性越强。
实验设计:同温下,取质量相同的这三种金属薄片,分别投入等体积等浓度的足量的稀盐酸中反应,观察现象。请回答下列问题。
(1)三种金属加入盐酸前都先用砂纸将表面擦光亮,其目的是________(填序号)。
A除去氧化膜,有利于直接反应 B使表面不平整,易反应
C使表面光亮,易观察现象 D使反应金属温度相同,易反应
(2)填写下表中的有关现象和结论。
金属 | Ti | Mg | Cu |
与盐酸反应现象 | 放出气泡速度缓慢 | 放出气泡速度快 | ______ |
结论 | 原假设中______(选填“a“b”或“a、b”)不正确,理由是:______;三种金属的活动性顺序为_____ | ||