��Ŀ����
����Ŀ��ʵ������һƿ̼��ƺ��Ȼ��Ʒ�ĩ��ɵľ��Ȼ���С������ͬ��������������ϡ����û���ﷴӦ��������Һ��Ϊ��������Һ��������ʵ�����ݼ�¼�������������㣨д��������̣�
ʵ����� | һ | �� | �� | �� |
ϡ��������/g | 100.0 | 100.0 | 100.0 | 100.0 |
���������/g | 3.0 | 6.0 | 9.0 | 12.0 |
������Һ����/g | 101.9 | 103.8 | 105.0 | a |
ʣ���������/g | 0 | 0 | m | n |
��1����������̼��ƺ��Ȼ�������֮��__________
��2������a��ֵΪ_______��
��3�������m��ֵ__________��
���𰸡�5��1 105.5 1.25g
��������
����ͼ�������ݷ�����ÿ����3.0g������Һ����1.9g�������μ�������9.0g����Һ��������Ϊ5.0gС��1.9g��3��˵�������ʣ�࣬ϡ������ȫ��Ӧ�����һ������ϡ���ỹ��ʣ�ࡣ
��1���⣺�ɷ�������һ�����ݿ�֪�����ɶ�����̼������Ϊ100.0+3.0g��101.9g��1.1g
��3.0g�������̼��Ƶ�����Ϊx��
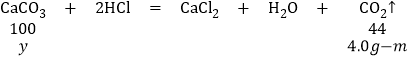
100��44=x��1.1g
x��2.5g
�������̼��ƺ��Ȼ�������֮��Ϊ2.5g����3.0g��2.5g����5��1
�𣺻������̼��ƺ��Ȼ�������֮��Ϊ5��1��
��2�����ڵ���������ʣ�࣬ϡ������ȫ��Ӧ�����Ե�����ȵ������ӵĻ���������Ϊ12.0g��9.0g��3.0g��3.0g������е��Ȼ�������Ϊ3.0g��2.5g��0.5g������a��105.0+0.5��105.5������105.5��
��3���⣺�������в���������̼������Ϊ100.0g+9.0g��105.0g��m��4.0g��m��
�跴Ӧ��̼��Ƶ�����Ϊy��
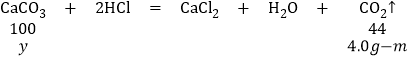
100��44=y��(4.0gm)�����y��![]() ��9.0g������е�̼�������Ϊ9.0g��
��9.0g������е�̼�������Ϊ9.0g��![]() ��7.5g������
��7.5g������![]() +m��7.5g��m��1.25g������1.25g��
+m��7.5g��m��1.25g������1.25g��