题目内容
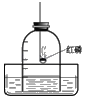
【题目】过氧化氢(H2O2)在二氧化锰(MnO2)作催化剂条件下,能迅速分解产生氧气,分液漏斗可以通过调节活塞控制液体的滴加速度.
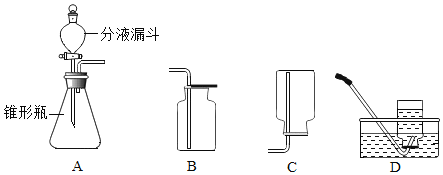
回答下列问题:
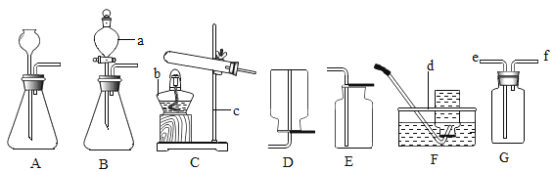
(1)分液漏斗中应放入的物质是_________,锥形瓶中应放入物质是_________;
(2)要收集一瓶纯净的氧气应选择装置_________,收集一瓶干燥的氧气应选择_________(填字母);
(3)某同学在观察到锥形瓶内有大量气泡时,开始用B装置收集氧气,过一段时间后,用带火星的木条伸入瓶口、瓶中、瓶底都未见木条复燃,其原因是_________;
(4)你认为用这个实验代替加热氯酸钾和二氧化锰混合物制取氧气,优点是_________(填编号);
a生成物只有氧气 b不需要加热 c需加热
(5)装置A中反应很剧烈,据此提出实验安全注意事项是_________(填编号)。
a控制液体滴加速度 b用体积较小的锥形瓶 c加热反应物
【答案】过氧化氢溶液 二氧化锰 D B 装置漏气(合理均可) b a
【解析】
(1)根据装置的用途和反应物的状态,确定里面装入的药品;
(2)根据收集气体的方法特点来分析;
(3)制取装置的气密性要良好;
(4)将过氧化氢溶液制取氧气的装置和氯酸钾和二氧化锰混合物加热制氧气的装置对比分析,找出优点;
(5)锥形瓶中的反应很剧烈,因此要控制液体的滴加速度,得到平稳的氧气流,以防装置爆炸。
(1)分液漏斗是用来装液体药品,应为过氧化氢溶液,则锥形瓶中装二氧化锰;
(2)排水法收集的氧比较纯净,向上排空气法来收集的氧气比较干燥;
(3)在观察到锥形瓶内有大量气泡时,开始用B装置收集氧气,过一段时间后,用带火星的木条伸入瓶口、瓶中和瓶底,都未见木条复燃,说明原因可能是装置漏气;
(4)若用过氧化氢分解制氧气代替氯酸钾加热制取氧气,优点是不需要使用酒精灯加热;
(5)a、控制液体的滴加速度,可使气流平稳生成,防装置爆炸,可以采用;
b、用体积小的锥形瓶,迅速生成的气体在有限空间内易发生爆炸或使液体喷出,造成危险,不可采用;c、加热反应物,会使反应更加剧烈,不可采用。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案【题目】元素周期表是学习和研究化学的重要工具,它的内容十分丰富。下表是元素周期表的部分内容,请认真分析并回答后面的问题:
IA | 0 | |||||||
1 | 1 H 氢 1.008 | 2 He 氦 4.003 | ||||||
IIA | IIIA | IVA | VA | VIA | VIIA | |||
2 | 3 Li 锂 6.941 | 4 Be 铍 9.012 | 5 B 硼 10.81 | 6 C 碳 12.01 | 7 N 氮 14.01 | 8 O 氧 16.00 | 9 F 氟 19.00 | 10 Ne 氖 20.18 |
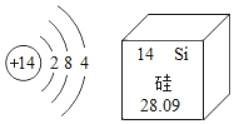
3 | 11 Na 钠 22.99 | 12 Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar 氩 39.95 |
(1)很多科学家对元素周期表的发现和完善做出了重大贡献,请写出其中一位科学家的名字:_________。
(2)请从上表中查出地壳中含量最多的金属元素的相对原子质量为__________。
(3)表中不同种元素最本质的区别是_________(填序号):
A相对原子质量不同 B质子数不同 C中子数不同
(4)元素周期表中每一个横行叫做一个周期,通过分析,同一周期元素之间的排列有一定的规律,如:__________(填字母序号)、……
A从左到右,各元素原子的电子层数相同
B从左到右,各元素原子的原子序数依次增加
C从左到右,各元素原子的最外层电子数相同
(5)元素周期表中,原子序数为12的镁元素的原子结构示意图如图,该原子在化学反应中易_________(填“得到”或“失去”)电子。说明元素的化学性质与原子的_______关系密切。

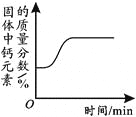
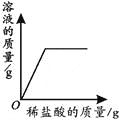
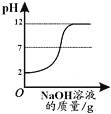
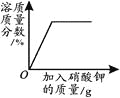
【题目】下列4个坐标图分别表示4个实验过程中的某些变化,其中正确的是
A | B | C | D |
高温煅烧一定质量的碳酸钙 | 向一定量铁粉中加入稀盐酸 | 向pH=2的稀盐酸中加入pH=12的氢氧化钠溶液 | 向接近饱和的硝酸钾溶液中加硝酸钾固体 |
|
|
|
|
A.AB.BC.CD.D