题目内容
【题目】在化学课上,老师带来一瓶未知溶液A。
(提出问题1)A是哪一类物质?
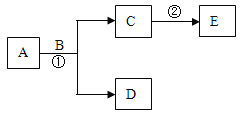
(实验探究1)进行如下实验:

观察到烧杯中的现象是(1)____,说明A是一种酸。
(提出问题2)A是哪一种酸?
老师要求甲、乙同学利用反应后的溶液B分别展开探究。
(猜想假设)甲同学:A是稀硫酸;乙同学:A是稀盐酸。
(实验探究2)
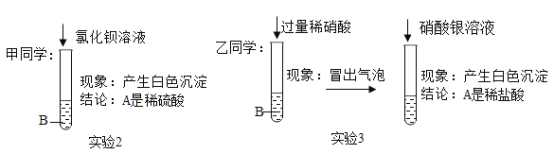
(评价交流)(2)____(填“甲”或“乙”)同学的实验得出正确结论,另一位同学的结论错误原因是(3)_____。
(实验探究3)将实验1实验3反应后的废液倒入同一烧杯中,充分反应后过滤,所得滤渣中一定含有(4)____,所得溶液中一定含有的离子是(5)_____。
(归纳总结)通过实验可以得出:选择试剂鉴别溶液中的待测离子时,如果待测溶液中含有干扰离子,则应在鉴别前,另选试剂将干扰离子除去。
【答案】有气泡产生 乙 白色沉淀不一定是硫酸与氯化钡反应生成的硫酸钡沉淀,可能是A烧杯中过量的碳酸钠与氯化钡反应生成的碳酸钡沉淀 氯化银 钠离子和硝酸根离子
【解析】
[实验探究1]
碳酸钠和酸反应产生二氧化碳气体,观察到烧杯中有气泡产生,说明A是一种酸。
故填:有气泡产生;
[评价交流]
(2)乙同学的实验得出正确结论,甲同学的结论错误原因是:白色沉淀不一定是硫酸与氯化钡反应生成的硫酸钡沉淀,可能是A烧杯中过量的碳酸钠与氯化钡反应生成的碳酸钡沉淀。
故填:乙;白色沉淀不一定是硫酸与氯化钡反应生成的硫酸钡沉淀,可能是A烧杯中过量的碳酸钠与氯化钡反应生成的碳酸钡沉淀;
[实验探究3]由实验3加入过量稀硝酸有气泡生成,说明实验1烧杯中有碳酸钠剩余,反应后的废液倒入同一烧杯中,充分反应后过滤,所得滤渣中一定含有氯化银,可能有碳酸银,所得溶液中一定含有的离子是钠离子和硝酸根离子。
故填:氯化银;钠离子和硝酸根离子。

【题目】小雨阅读课外资料得知:氯酸钾的分解可用二氧化锰、氧化铜等物质作催化剂。于是,他对影响氯酸钾分解的因素及催化剂的催化效果产生了探究兴趣。
(提出问题)氧化铜是否比二氧化锰催化效果更好?影响氯酸钾分解速率的因素有哪些呢?
(设计实验)小雨以生成等体积的氧气为标准,设计了下列几组实验。
序号 | KClO3的质量 | 其他物质的质量 | 温度 | 氧气的体积 | 反应所需时间 |
① | 10.0 g | 330 ℃ | 100 mL | t1 | |
② | 10.0 g | CuO 1.5 g | 330 ℃ | 100 mL | t2 |
③ | 10.0 g | MnO2 1.5 g | 330 ℃ | 100 mL | t3 |
④ | 10.0 g | MnO2___g | 380 ℃ | 100 mL | t4 |
(1)若t1>t2,说明氧化铜能加快氯酸钾的分解速率。若要确定氧化铜是此反应的催化剂,还需探究反应前后,氧化铜的___________和____________不变。
(2)写出实验④所涉及的化学反应的文字表达式_______。
(3)实验④中MnO2的质量为_________g,若t3>t4,则化学反应快慢与温度的关系是_____。
(4)氯酸钾的分解速率可能还与_____________因素有关。
【题目】NaCl和KNO3在不同温度时的溶解度如下,回答下列问题:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.8 | 110 | |
(1)如图为NaCl和KNO3的溶解度曲线,则表示NaCl的溶解度曲线是________(填“甲”或“乙”);其中温度t的范围应在________(填字母序号)。
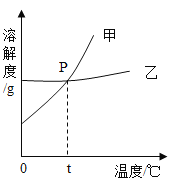
A 10℃~20℃之间 B 20℃~30℃之间 C 30℃40℃之间 D 40℃~50℃之间
(2)若甲物质中含有少量的乙物质,提纯甲物质的方法是________。
(3)在0℃时,分别在100g水中加入30g NaCl和KNO3固体,再加热到60℃时(假设溶剂不损耗),加热前后,有关两种溶液的说法正确的是________(填字母序号)。
A 0℃时,两溶液中溶质的质量分数相同
B 60℃时两溶液中溶质的质量分数相同
C 加热前后,NaCl溶液中溶质的质量分数由小变大
D 加热前后,KNO3溶液中溶质的质量分数不变