题目内容
【题目】人体所需的维生素C(化学式为C6H8O6)主要从蔬菜和水果中摄取,请计算。
(1)维生素C的相对分子质量。
(2)维生素C中各元素的质量比。
(3)如要配制溶质的质量分数为0.3%的维生素C溶液1000克,需要向溶质的质量分数为6%的维生素C溶液中加水多少克?
【答案】(1)176
(2)9:1:12
(3)950
【解析】
(1)维生素C的相对分子质量为:12×6+8+16×6=176;
(2)维生素C中C、H、O元素的质量比为:(12×6):(1×8):(16×6)=9:1:12;
(3)如要配制溶质质量分数为0.3%的维生素C溶液1000克,需要溶质质量分数为6%的维生素C溶液的质量为:![]() ,需要加水的质量为:1000g-50g=950g。
,需要加水的质量为:1000g-50g=950g。

【题目】用“盐酸—硫化钡法”生产BaCl2会放出有毒气体H2S(其水溶液呈酸性),可用NaOH吸收H2S制取Na2S进行处理。下表为H2S回收工艺的各项生产成本:
项目 | 单价(元/吨) |
NaOH | 6000 |
Na2S | 5000 |
辅助费用(以处理1吨H2S计) | 1114 |
(1)工业处理尾气需考虑经济效益和社会效益,根据上述资料分析,单从经济效益考虑,这种处理H2S的方法是______________(填“盈利”或“亏损”)的;
(2)“盐酸—硫化钡法”生产的BaCl2溶液中常会混有盐酸,为了测定该溶液中BaCl2的溶质质量分数,某同学做了如下实验:取该产品液10.0 g于烧杯中,逐滴滴入质量分数为5.3%的Na2CO3溶液至过量。记录滴入Na2CO3溶液的质量与有关量的变化关系如图1和图2所示:
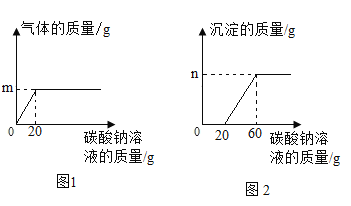
①m=________;n=________。
②与氯化钡反应的碳酸钠溶液的质量是________g。
③请计算该溶液中BaCl2的质量分数。(写出计算过程)
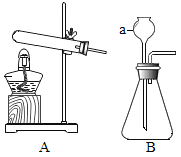
【题目】根据如图所示实验装置,回答问题.
发生装置 | 收集装置 | 洗气装置 |
|
|
|
(1)写出图中仪器a的名称:___.
(2)实验室用加热氯酸钾和二氧化锰混合物制取氧气的化学方程式为___,可选择的收集装置为___(填字母).
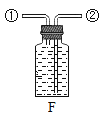
(3)实验室用石灰石和稀盐酸反应制取二氧化碳,可选择的发生装置是___,该反应生成的二氧化碳气体中常混有少量氯化氢气体,可通过盛有饱和碳酸氢钠溶液的F装置除去氯化氢气体,则该混合气体应从F装置的___口(填“①”或“②”)通入.