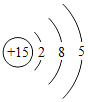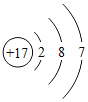题目内容
【题目】自来水是我国目前主要的生活饮用水,下表是我国颁布的生活饮用水水质标准的部分内容。
项目 | 标准 |
感官指标 | 无异味、异臭等 |
化学指标 | pH6.5-8.5, 铜<1.0mg. L-1,铁<0.3mg. L-1,游离氯≥0.3mg. L-1等 |
(1)感官指标表现的是自来水的____________性质(填“物理”或“化学”);若化学指标中的pH=8时,表明自来水呈_____________(填“酸性”、“碱性”或“中性”)。
(2)自来水厂常用的消毒剂有二氧化氯(CIO2 )、漂白粉[Ca(CIO)2 ]、“ 消毒液”( NaClO)等。工业上制取漂白粉的化学方程式为![]() ,制取“84消毒液” 是将氯气通入烧碱溶液中,反应原理与漂白粉的制取相似,请写出该反应的化学方程式:______________。
,制取“84消毒液” 是将氯气通入烧碱溶液中,反应原理与漂白粉的制取相似,请写出该反应的化学方程式:______________。
(3)生活中对井水通过____________的方法既可以消毒杀菌,也可以降低水的硬度。
【答案】物理 碱性 ![]() 煮沸
煮沸
【解析】
(1)物理性质是指物质不需要发生化学变化就可以表现出来的性质;化学性质是指物质在化学变化中表现出来的性质。由图中信息可知,感官指标通常指的是物质的异味、臭味等,属于物理性质。pH< 7,溶液显酸性,pH=7,溶液呈中性,pH> 7,溶液显碱性。化学指标中pH = 8,表明自来水呈碱性;
(2)氢氧化钠能与氯气反应生成氯化钠、次氯酸钠和水,其化学反应方程式为:![]() ;
;
(3)生活中对井水通过煮沸的方法既可以消毒杀菌,也可以降低水的硬度。

【题目】分类和类比是学习化学常用的方法。
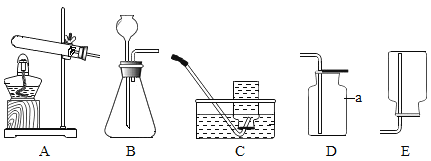
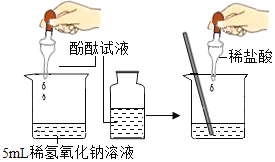
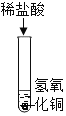
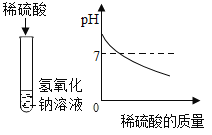
(1)下列实验都能探究酸与碱之间能否发生反应。请从“定性研究”或“定量研究”的角度,将下列实验中的A与_________(填字母)归为一类,理由是_____________。
|
在少量的氢氧化铜固体中加入足量的稀盐酸 |
在氢氧化钠溶液不断滴加稀硫酸,边加边用酸度计测定溶液的pH |
A | B | C |
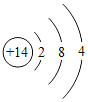
(2)非金属与氢气反应的条件越容易、反应越剧烈,则非金属元素的非金属性越强。据此规律,可推断出第三周期非金属元素的非金属性强弱的顺序为__________________;结构决定性质,请归纳位于第三周期元素的原子结构与元素性质的递变规律______________________。
元素 | Si | p | S | Cl |
单质与氢气的反应条件 | 高温 | 磷蒸气与氢气能反应 | 加热 | 加热或点燃时发生爆炸 |
原子核外电子排布 |
|
|
|
|