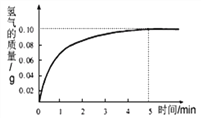
题目内容
【题目】除去NaCl溶液中CaCl2、MgSO4杂质依次加入的试剂有:①过量的Ba(OH)2溶液,②过量的X溶液,③过量的盐酸。
(1)请写出加入X溶液时发生的一个反应的化学方程式___________________。
(2)加入①、②后所得溶液中除了氯化钠还含有什么溶质____?
(3)过滤操作应排在什么位置_________?
【答案】![]() (或
(或![]() ) NaOH、Na2CO3 在②之后③之前
) NaOH、Na2CO3 在②之后③之前
【解析】
要除去NaCl溶液中的CaCl2、MgSO4杂质,加入过量的氢氧化钡,氢氧化钡能与硫酸镁反应生成氢氧化镁和硫酸钡,除去硫酸镁,溶液中含有氯化钙,氯化钙能与碳酸钠反应生成碳酸钙和氯化钠,故要除去氯化钙,X溶液应为碳酸钠,碳酸钠能与氯化钙反应生成碳酸钙和氯化钠,该反应的化学方程式为:![]() ,碳酸钠还能与过量的氢氧化钡反应生成碳酸钡和氢氧化钠,该反应的化学方程式为:
,碳酸钠还能与过量的氢氧化钡反应生成碳酸钡和氢氧化钠,该反应的化学方程式为:![]() ,最后加入过量盐酸,氢氧化钠与盐酸反应生成氯化钠和水,碳酸钠与盐酸反应生成氯化钠、二氧化碳和水。
,最后加入过量盐酸,氢氧化钠与盐酸反应生成氯化钠和水,碳酸钠与盐酸反应生成氯化钠、二氧化碳和水。
(1)由分析可知,加入X溶液时,发生的一个反应的化学方程式为:![]() (或
(或![]() );
);
(2)加入过量氢氧化钡,![]() ,加入过量的碳酸钠,
,加入过量的碳酸钠,![]() ,
,![]() ,碳酸钠过量,故加入①、②后所得溶液中除了氯化钠还含有碳酸钠、氢氧化钠;
,碳酸钠过量,故加入①、②后所得溶液中除了氯化钠还含有碳酸钠、氢氧化钠;
(3)过滤应在②之后③之前,因为①②中都有沉淀生成,应在②之后过滤,③中加入了盐酸,盐酸能与氢氧化镁、碳酸钡、碳酸钙反应,故应在③之前除去,故填:在②之后③之前。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案【题目】自来水是我国目前主要的生活饮用水,下表是我国颁布的生活饮用水水质标准的部分内容。
项目 | 标准 |
感官指标 | 无异味、异臭等 |
化学指标 | pH6.5-8.5, 铜<1.0mg. L-1,铁<0.3mg. L-1,游离氯≥0.3mg. L-1等 |
(1)感官指标表现的是自来水的____________性质(填“物理”或“化学”);若化学指标中的pH=8时,表明自来水呈_____________(填“酸性”、“碱性”或“中性”)。
(2)自来水厂常用的消毒剂有二氧化氯(CIO2 )、漂白粉[Ca(CIO)2 ]、“ 消毒液”( NaClO)等。工业上制取漂白粉的化学方程式为![]() ,制取“84消毒液” 是将氯气通入烧碱溶液中,反应原理与漂白粉的制取相似,请写出该反应的化学方程式:______________。
,制取“84消毒液” 是将氯气通入烧碱溶液中,反应原理与漂白粉的制取相似,请写出该反应的化学方程式:______________。
(3)生活中对井水通过____________的方法既可以消毒杀菌,也可以降低水的硬度。
【题目】学习了CO2的有关知识之后,同学们查阅资料发现Mg能在CO2中燃烧,反应的化学方程式:2Mg+CO2![]() 2MgO+C,所以镁着火不能用CO2来灭火。根据镁能在CO2中燃烧,同学们对钠能否与用CO2反应进行探究。
2MgO+C,所以镁着火不能用CO2来灭火。根据镁能在CO2中燃烧,同学们对钠能否与用CO2反应进行探究。
(提出猜想)Na应该也能在CO2中燃烧。
(实验)将燃着的钠伸入装有CO2的集气瓶中,钠能在CO2中继续燃烧。
(查阅资料)
①Na2O是白色固体,能与CO2反应生成Na2CO3,与H2O反应生成NaOH。
②Ba(OH)2溶于水,而BaCO3不溶于水。
③Na2CO3的存在会干扰NaOH的检测。
基于以上资料,同学们认为钠在CO2中燃烧的产物应该与Mg在CO2中燃烧的产物情况有所不同,并对产物提出了以下几种猜想:
①Na2O、C ②Na2CO3、C ③NaOH、C ④Na2O、Na2CO3、C通过理论分析,猜想_____(填序号)肯定是错误的,理由是:_____。
(验证猜想)
步骤 | 实验操作 | 主要实验现象 | 结论(燃烧产物判断) |
① | 将产物溶于适量水中 | 部分溶解,试管底部有黑色固体 | 燃烧产物中肯定有_____ |
② | 取①所得上层清液少量于试管中,加入_____; | _____ | 燃烧产物中肯定有Na2CO3 |
③ | 取②所得上层清液少量于试管中,加入_____。 | 溶液由无色变为红色 | 燃烧产物中肯定有Na2O |
(结论)猜想④正确,所以钠与CO2反应生成Na2O、Na2CO3、C的化学方程式是_____。