题目内容
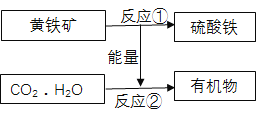
【题目】石膏(CaSO42H2O)是一种用途广泛的工业材料和建筑材料,工业上用含SO2的烟气制备石膏的简要流程图如下:
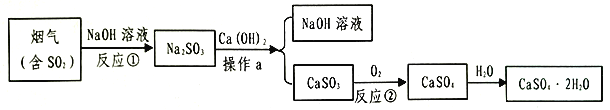
(1)在反应①时,常将NaOH喷成雾状的原因是___________________.
(2)操作a的名称是__________,在实验室里进行该操作,玻璃棒的作用是__________.
(3)CaSO3不易溶于水,它属于________(填“酸”、“碱”、“盐”或“氧化物”),其中硫元素的化合价为________,反应②的化学方程式是_________________________.
(4)生产流程中生成的______________可循环利用,节约成本.
【答案】 增大与二氧化硫的接触面积,提高反应速率 . 过滤 , 引流 . 盐 +4 , 2CaSO3+O2=2CaSO4 . 氢氧化钠溶液
【解析】本题是流程题。解题的关键是读懂流程,解答题目时先看解答的问题是什么,然后带着问题去读流程图进而去寻找解答有用的信息,提高信息捕捉的有效性。
(1)接触面积越大,反应速率越大或者吸收效率越高,所以在反应①时,常将NaOH喷成雾状,这样增大与二氧化硫的接触面积,提高吸收或者反应的速率;
(2)操作a是将难溶性物质亚硫酸钙和可溶性物质氢氧化钠分离的,所以是过滤.在实验室里进行过滤操作时,玻璃棒的作用是引流;
(3)CaSO3是金属离子和酸根离子形成的化合物,属于盐;设:CaSO3中硫元素的化合价为x,根据化合物中元素的化合价代数和为零,则有(+2)×1+x+(-2)×3=0,x=+4;反应②中反应物为亚硫酸钙和氧气,生成物为硫酸钙,所以对应的化学方程式是 2CaSO3+O2=2CaSO4;
(4)循环使用的物质在前面的反应中是反应物,到了后面的反应中又成了生成物。由于反应过程需要用到氢氧化钠溶液,中间过程也会生成氢氧化钠,所以在过程可以循环使用氢氧化钠溶液,节约成本。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】化学兴趣小组的同学欲测定实验室中某黄铜(铜锌合金)样品中铜的质量分数(不考虑黄铜中的其他杂质,请你参与他们的探究过程。称量10 g粉末状黄铜样品放入烧杯中,量取45 mL稀盐酸分三次加到其中,每次充分反应后,测定生成氢气的质量,实验数据如表:
第一次 | 第二次 | 第三次 | |
加入稀盐酸的体积(mL) | 15 | 15 | 15 |
生成氢气的质量(g) | 0.04 | m | 0.02 |
试求:
(1)求m的数值。m=_________
(2)求此黄铜样品中铜的质量分数________。