题目内容
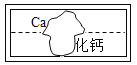
【题目】在学习盐的性质时,某组同学将碳酸钠溶液和一瓶常见但标签破损的溶液 (如图)进行反应,有白色沉淀产生,过滤后得到澄清溶液。同学们对该实验进行了一系列的探究。
探究一:M溶液中的溶质是什么?
(1)(提出猜想)该组同学认为M物质的溶质有两种可能:
①溶质是________;②溶质 CaCl2。
(收集资料CaCl2水溶液呈中性。
(2)(设计实验)同学们设计了如下方案并进行实验:
实验操作 | 实验现象 | 实验结论 |
取少量M溶液于试管中,向其中滴加_____________ | _____________ | 猜想①正确 |
根据上述结论,写出碳酸钠和溶液M反应的化学方程式为________________。
(3)探究二:过滤后澄清滤液中会有哪些溶质?
(提出猜想)猜想一 NaOH和Na2CO3;猜想二:_______________;猜想三NaOH;
(4)(实验验证)同学们针对“猜想一”进行了如下实验:
实验步骤 | 实验现象 | 实验结论 |
取样于试管中,滴入几滴稀盐酸 | _____________ | “猜想一”不成立 |
他们的结论是否正确?_____________,理由是_____________。
【答案】Ca(OH)2 酚酞试液 溶液变红 ![]() NaOH和Ca(OH)2 没有气泡 不正确 滴入的盐酸太少
NaOH和Ca(OH)2 没有气泡 不正确 滴入的盐酸太少
【解析】
(1)由标签可知,溶液为钙的化合物溶液,能与碳酸钠的反应可能是氢氧化钙或氯化钙,所以猜想为Ca(OH)2;
(2)由于氢氧化钙溶液显碱性,氯化钙溶液呈中性,所以加入酚酞试液溶液会变红,故猜想①正确;碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式为:![]() ;
;
(3)碳酸钠与氢氧化钙反应生成了碳酸钙沉淀和氢氧化钠,碳酸钠过量时,滤液中会有的溶质是NaOH和Na2CO3,氢氧化钙过量时,滤液中会有的溶质是NaOH和Ca(OH)2,恰好完全反应时,滤液中会有的溶质是NaOH。猜想二是:NaOH和Ca(OH)2 ;
(4)NaOH和Na2CO3混合物滴加盐酸时,盐酸先与氢氧化钠反应,等氢氧化钠完全反应后,盐酸才与碳酸钠反应放出气体。当滴入的盐酸太少时,没有产生气体,不能确定猜想一不成立。他们的实验结论不正确。

 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案【题目】在一个密闭容器中放入X、Y、Z、W 四种物质,在一定条件下发生化学反应,一段时间后,测得有关说法如下表,则关于此反应的认识不正确的是 ( )
物质 | X | Y | Z | W |
反应前的质量 | 2 | 1 | 16 | 16 |
反应后的质量 | 17 | m | 6 | 11 |
A.物质Y 可能是该反应的催化剂B.该反应为复分解反应
C.反应后 Z 和Y 的质量比为 6:1D.参加反应的 Z 和W 的质量比为 2:1