题目内容
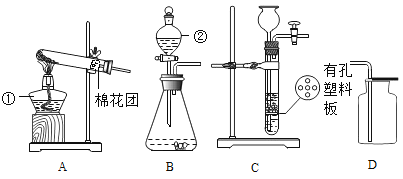
【题目】下图是配制溶质质量分数为10%的NaCl溶液的实验操作示意图:
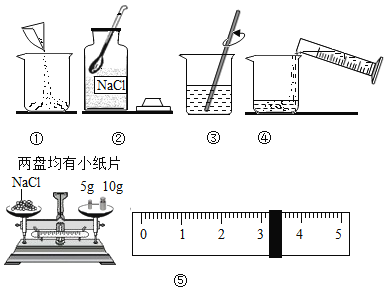
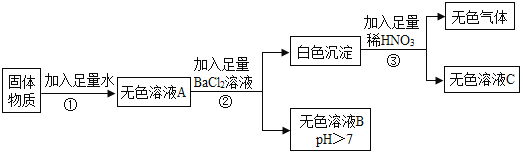
(1)用上图表示的序号表示配制溶液的正确操作顺序__________。
(2)图②中,有一种塑料仪器,其名称是______________。
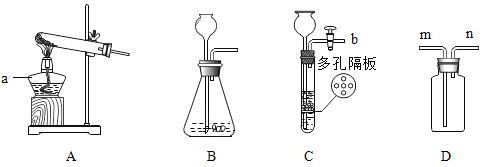
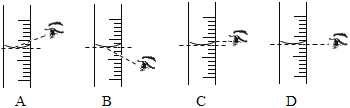
(3)根据计算需要量取水的体积是_____________(水的密度为1 g/mL)。量取所需要的水应选择__________(选填“50 mL”、“100 mL”或“200 mL”)量筒。量取读数时,下图视线角度正确的是______________。 (选填字母标号)
(4)溶解:用量筒量取所需的水,倒入装有氯化钠固体的烧杯里,用玻璃棒搅拌,其目的是______________。
(5)在配制过程中,能导致溶液中NaCl 质量分数小于10%的可能的原因是______________。
①用量筒量取水时仰视读数 ②向烧杯中倒NaCl时洒了一些 ③配制溶液的烧杯用水洗涤后未干燥就使用 ④氯化钠晶体不纯
A①②③④ B只有①③④ C只有①②③ D只有②③④
【答案】②⑤①④③ 药匙 163.8mL 200mL D 加速溶解 B
【解析】
(1)配制溶液的正确操作顺序:先计算:②取药、⑤称量、①转移药品、④加水、③搅拌、溶解;
故正确操作顺序:②⑤①④③;
(2)图②中,有一种塑料仪器,其名称是:药匙,用于取用固体药品;
(3)天平中氯化钠的质量=10g+5g+3.2g=18.2g,配制溶质质量分数为10%的NaCl溶液的质量=![]() ;需要量取水的体积是=
;需要量取水的体积是=![]() 。量取所需要的水应选择量程稍大于水的体积的200 mL量筒。量取读数时,下图视线角度正确的是:D,应该平时量筒中凹液面最低处;
。量取所需要的水应选择量程稍大于水的体积的200 mL量筒。量取读数时,下图视线角度正确的是:D,应该平时量筒中凹液面最低处;
(4)溶解:用量筒量取所需的水,倒入装有氯化钠固体的烧杯里,用玻璃棒搅拌,其目的是:加速固体药品溶解;
(5)在配制过程中,能导致溶液中NaCl 质量分数小于10%的可能的原因是:
①用量筒量取水时仰视读数,则实际量取说的体积偏大,溶剂质量偏大;导致质量分数偏小;
②向烧杯中倒NaCl时洒了一些,使溶质质量偏小;导致质量分数变大
③配制溶液的烧杯用水洗涤后未干燥就使用,导致溶剂质量偏大,溶质质量分数变小;
④氯化钠晶体不纯,导致溶质质量偏小,溶质质量分数偏小;
导致质量分数小于10%的有:①③④;
故选:B。

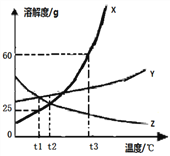
【题目】KCl和KNO3在不同温度下的溶解度数据如表所示,下列说法中正确的是
温度/℃ | 20 | 30 | 60 | |
溶解度/g | KCl | 33 | 38 | 45 |
KNO3 | 31 | 64 | 110 |
A. 60℃时,100g水中最多溶解45 g KCl
B. 随着温度的升高,某饱和KCl溶液中会有固体析出
C. KNO3的溶解度始终大于KCl
D. 60℃时,某KNO3溶液中溶质的质量分数一定为 ![]()
【题目】在学习盐的性质时,某组同学将碳酸钠溶液和一瓶常见但标签破损的溶液 (如图)进行反应,有白色沉淀产生,过滤后得到澄清溶液。同学们对该实验进行了一系列的探究。
探究一:M溶液中的溶质是什么?
(1)(提出猜想)该组同学认为M物质的溶质有两种可能:
①溶质是________;②溶质 CaCl2。
(收集资料CaCl2水溶液呈中性。
(2)(设计实验)同学们设计了如下方案并进行实验:
实验操作 | 实验现象 | 实验结论 |
取少量M溶液于试管中,向其中滴加_____________ | _____________ | 猜想①正确 |
根据上述结论,写出碳酸钠和溶液M反应的化学方程式为________________。
(3)探究二:过滤后澄清滤液中会有哪些溶质?
(提出猜想)猜想一 NaOH和Na2CO3;猜想二:_______________;猜想三NaOH;
(4)(实验验证)同学们针对“猜想一”进行了如下实验:
实验步骤 | 实验现象 | 实验结论 |
取样于试管中,滴入几滴稀盐酸 | _____________ | “猜想一”不成立 |
他们的结论是否正确?_____________,理由是_____________。