题目内容
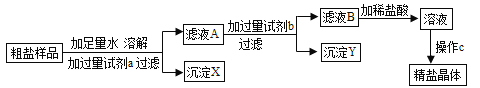
【题目】已知废旧干电池填料中含有二氧化锰、氯化铵和氯化锌等,某化学兴趣小组想回收利用废旧干电池中的二氧化锰和氯化铵,设计了如下流程:

(1)操作1和操作2的名称都是_____,该操作中用到的玻璃仪器除漏斗、烧杯外,还需要_____,其作用是_____。
(2)灼烧滤渣l时,会产生一种使澄清石灰水变浑浊的气体,由此推测滤渣1中除含有MnO2外,还存在的物质是_____。
(3)己知滤液1中氯化铵和氯化锌的浓度相近.在某温度下蒸发滤液1时,大量的氯化铵晶体先析出,说明该温度下氯化铵溶解度_____氯化锌的溶解度(填“<”、“=”或“>”)。
(4)同学们还设计了下列实验探究滤液2中的溶质成分。
(猜想)猜想一:氯化锌 猜想二:_____ 猜想三:氯化锌和氯化铵
(查阅资料)在氯化锌溶液中逐滴滴入稀氨水,先会生成白色沉淀,继续滴加白色沉淀会溶解。
(实验探究)
实验步骤 | 实验现象 | 实验结论 |
取少量滤液2,加入到过量氢氧化钠溶液中,并加热 | _____ | 滤液2中含有氯化铵 |
另取少量滤液2,_____ | _____ | 滤液2中含有氯化锌 |
(结论)猜想三成立。
【答案】过滤 玻璃棒 引流 C(或碳) < 氯化铵(或NH4Cl) 有刺激性气味气体产生 逐滴滴入足量稀氨水 先产生白色沉淀,后溶解
【解析】
(1)根据流程图操作1和2都是不溶性固体和液体的分离,因此是过滤操作,过滤操作时玻璃仪器有漏斗、烧杯和玻璃棒,过滤时玻璃棒起到引流的作用;
(2)使澄清石灰水变浑浊的气体为二氧化碳,二氧化碳可由黑色的碳单质灼烧制得,所以该黑色物质是碳单质;
(3)己知滤液1中氯化铵和氯化锌的浓度相近。在某温度下蒸发滤液 1 时,大量的氯化铵晶体先析出,氯化锌不析出,说明氯化铵的溶解度小于氯化锌的溶解度;
(4)猜想:
滤液1中含有氯化铵和氯化锌,由于氯化铵结晶出一部分,所以剩余的滤液2中应该还有氯化锌和氯化铵,且此时的溶液为氯化铵(或NH4Cl)的饱和溶液;
证明氯化铵的存在,要证明铵根离子的存在,取少量滤液2,加入到过量的氢氧化钠溶液中并加热,有刺激性气味气体产生,滤液2中含有氯化铵。
证明氯化锌的存在,要证明锌离子的存在,取少量滤液2,逐滴滴入足量稀氨水,先产生白色沉淀,后溶解,滤液2中含有氯化锌。因此:
实验步骤 | 实验现象 | 实验结论 |
取少量滤液2,加入到过量的氢氧化钠溶液中并加热 | 有刺激性气味气体产生 | 滤液2中含有氯化铵 |
另取少量滤液2,逐滴滴入足量稀氨水 | 先产生白色沉淀,后溶解 | 滤液2中含有氯化锌 |

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】请从A或B两题中任选一个作答,若两题均作答,按A计分。
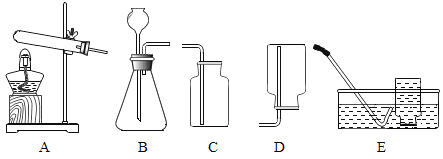
A | B |
(1)实验室用高锰酸钾制取氧气的化学方程式是________。 (2)用装置A、E制取氧气。选用装置E收集氧气的原因是________。 | (1)实验室制取二氧化碳的化学方程式是________ (2)用装置B、C制取二氧化碳。检验二氧化碳已收集满的操作是________。 |
【题目】某兴趣小组在探究金属和盐溶液反应时,发现将金属钠放入硫酸铜溶液中有气泡和沉淀产生。为了探究生成的气体和固体沉淀的成分与产生原因,同学们分别进行了如下实验:
(提出问题)产生的气体是什么?
(猜想与假设)猜想一:二氧化硫;猜想二:二氧化碳;猜想三:氢气。你认为不合理的猜想是____,原因是______________________________。
(查阅资料)①SO2与CO2化学性质相似,都能与澄清石灰水反应生成白色沉淀。
②钠是一种非常活泼的金属,能与冷水剧烈反应,化学方程式为2Na+2H2O=2NaOH+H2↑。
(方案设计)依据上述猜想,实验小组同学分别设计了如下方案:
(1)甲同学验证生成的气体是否为SO2,他将生成的气体通入澄清石灰水中,发现______,确定生成的气体不是SO2。
(2)乙同学利用如图所示装置验证生成的气体是H2。实验过程中可观察到玻璃管中的现象是_______,发生反应的化学方程式为______________________。
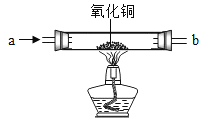
(得出结论)猜想三正确。
(拓展延伸)钠与硫酸铜溶液反应生成的沉淀是什么?
(分析讨论)同学们认为钠可能会先与水反应生成氢氧化钠和氢气,氢氧化钠再与硫酸铜反应生成蓝色的氢氧化铜沉淀。
(3)丙同学提出异议:除了上述反应,可能钠也可直接与硫酸铜反应生成红色的单质铜,只是蓝色的Cu(OH)2掩盖了红色的铜。请设计实验证明该蓝色沉淀中不含单质铜。
实验步骤与现象 | 结论 |
_________ | 该蓝色沉淀中不含单质铜 |
(4)由上述探究,同学们认为硫酸铜溶液可能呈____性,他们可以选择______(填试剂名称)来验证。