题目内容
【题目】用化学方程式解释下列原理或现象。
(1)稀盐酸除铁锈时间过长,溶液中出现了气泡_____。
(2)医生用胃舒平[主要成分Al(OH)3]治疗胃酸过多_____。
(3)氨气(NH3)在氧气中燃烧,生成一种生活中常见的液体和空气中含量最多的气体_____。
【答案】Fe+2HCl═FeCl2+H2↑ Al(OH)3+3HCl═AlCl3+3H2O 4NH3+3O2![]() 6H2O+2N2
6H2O+2N2
【解析】
(1)稀盐酸除铁锈时间过长,溶液中出现了气泡,是因为稀盐酸和氧化铁反应后,能和铁反应生成氯化亚铁和氢气;
(2)医生用胃舒平[主要成分Al(OH)3]治疗胃酸过多时,氢氧化铝能和稀盐酸反应生成氯化铝和水;
(3)氨气(NH3)在氧气中燃烧,生成一种生活中常见的液体(水)和空气中含量最多的气体(氮气)。
(1)当稀盐酸与表面的氧化铁反应完全后,稀盐酸和铁反应生成氯化亚铁和氢气,化学方程式为:Fe+2HCl═FeCl2+H2↑。
故答案为:Fe+2HCl═FeCl2+H2↑。
(2)医生用胃舒平[主要成分Al(OH)3]治疗胃酸过多时,氢氧化铝能和稀盐酸反应生成氯化铝和水,反应的化学方程式为:Al(OH)3+3HCl═AlCl3+3H2O。
故答案为:Al(OH)3+3HCl═AlCl3+3H2O。
(3)氨气(NH3)在氧气中燃烧,生成一种生活中常见的液体(水)和空气中含量最多的气体(氮气),反应的化学方程式为:4NH3+3O2![]() 6H2O+2N2。
6H2O+2N2。
故答案为:4NH3+3O2![]() 6H2O+2N2。
6H2O+2N2。

【题目】化学兴趣小组的同学发现有一瓶氢氧化钠溶液没有塞橡皮塞,在老师指导下,开展了以下探究:
(提出问题1)该氢氧化钠溶液是否变质了呢?
(实验探究1)
实验操作 | 实验现象 | 实验结论 |
取少量该溶液于试管中,向溶液中滴加稀盐酸,并不断振荡。 | 有气泡冒出。 | 氢氧化钠溶液一定变质了。 |
(提出问题2)该氢氧化钠溶液是全部变质还是部分变质呢?
(猜想与假设)猜想1:氢氧化钠溶液部分变质。猜想2:氢氧化钠溶液全部变质。
(查阅资料)(1)氯化钙溶液呈中性。
(2)氯化钙溶液能与碳酸钠溶液反应:CaCl2+Na2CO3=CaCO3↓+2NaCl
(实验探究2)
实验步骤 | 实验现象 | 实验结论 |
(1)取少量该溶液于试管中,向溶液中滴加过量的氯化钙溶液,并不断振荡。 | 有________生成。 | 说明原溶液中一定有碳酸钠。 |
(2)取步骤(1)试管中的少量上层清液,滴加酚酞溶液。 | 溶液变红色。 | 说明原溶液中一定有_________。 |
(实验结论)该氢氧化钠溶液___________(填“部分”或“全部”)变质。
(反思与评价)
(1)氢氧化钠溶液露置于空气中容易变质,发生反应的化学方程式是_______________。
(2)在上述(实验探究2)中,小明提出可用氢氧化钙溶液代替氯化钙溶液,你认为该方案____(填“可行”或“不可行”)。
(理解与应用)氢氧化钠溶液容易变质,必须密封保存。实验室必须密封保存的药品还有很多,试另举一例:_________________________________________。
【题目】元素周期表是学习化学的重要工具。下表是元素周期表的一部分,请依据此表回答有关问题。
第一周期 | 1 H 1.008 | 2 He 4.003 | ||||||
第二周期 | 3 Li 6.941 | 4 Be 9.012 | 5 B 10.81 | 6 C 12.01 | 7 N 14.01 | 8 O 16.00 | 9 F 19.00 | 10 Ne 20.18 |
第三周期 | 11 Na 22.99 | 12 Mg 24.31 | 13 Al 26.98 | 14 Si 28.09 | 15 P 30.97 | 16 S 32.06 | 17 Cl 35.45 | 18 Ar 39.95 |
(1)第二周期中,铍(Be)元素的相对原子质量为_____。第3周期中,属于金属元素的有_____(填元素名称)。
(2)氧元素的原子结构示意图为: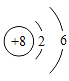 , 第3周期中某元素与氧元素的化学性质相似,该元素的原子结构示意图为:
, 第3周期中某元素与氧元素的化学性质相似,该元素的原子结构示意图为: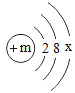 ,则x=_____,m=_____。
,则x=_____,m=_____。
(3)请在原子序数分别为1、8、11、17的四种元素中,选择适当的元素组成物质,这些物质之间能发生中和反应的化学方程式为_____。请选1、6、8、11用其中的元素写出符合要求的化学式一个:
①常温下为气态的非金属氧化物_____。
②由三种元素组成的碱_____。
③由四种元素组成的盐_____。
④能用于实验室制O2,且原子个数比为1:1的物质_____。
【题目】学校研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200 g,平均分成4份进行实验,结果如下:
实 验 | 一 | 二 | 三 | 四 |
加入样品的质量/g | 5 | 10 | 15 | 20 |
生成CO2的质量/g | 1.76 | m | 4.4 | 4.4 |
(1)上表中m的数值是_____ ;
(2)反应中矿石有剩余是第_____次实验;
(3)这种石灰石矿中碳酸钙的质量分数是_____;
(4)稀盐酸中溶质的质量分数是多少?_____
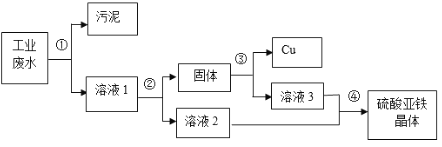
【题目】已知废旧干电池填料中含有二氧化锰、氯化铵和氯化锌等,某化学兴趣小组想回收利用废旧干电池中的二氧化锰和氯化铵,设计了如下流程:

(1)操作1和操作2的名称都是_____,该操作中用到的玻璃仪器除漏斗、烧杯外,还需要_____,其作用是_____。
(2)灼烧滤渣l时,会产生一种使澄清石灰水变浑浊的气体,由此推测滤渣1中除含有MnO2外,还存在的物质是_____。
(3)己知滤液1中氯化铵和氯化锌的浓度相近.在某温度下蒸发滤液1时,大量的氯化铵晶体先析出,说明该温度下氯化铵溶解度_____氯化锌的溶解度(填“<”、“=”或“>”)。
(4)同学们还设计了下列实验探究滤液2中的溶质成分。
(猜想)猜想一:氯化锌 猜想二:_____ 猜想三:氯化锌和氯化铵
(查阅资料)在氯化锌溶液中逐滴滴入稀氨水,先会生成白色沉淀,继续滴加白色沉淀会溶解。
(实验探究)
实验步骤 | 实验现象 | 实验结论 |
取少量滤液2,加入到过量氢氧化钠溶液中,并加热 | _____ | 滤液2中含有氯化铵 |
另取少量滤液2,_____ | _____ | 滤液2中含有氯化锌 |
(结论)猜想三成立。