题目内容
【题目】化学是一门以实验为基础的科学。某化学兴趣小组做铁与硫酸铜溶液反应实验时,观察到把铁丝插入盛有硫酸铜溶液的试管中,铁丝表面先有少量气泡产生,然后铁丝表面才有红色物质生成。这一现象激发了同学们的探究欲,请同他们一起进行探究:
[提出问题]生成的气体是什么?
[猜想与假设]①甲同学认为是氧气; ②乙同学认为是二氧化硫; ③丙同学认为是氢气。
[实验设计](1)验证甲同学的猜想,应用_____来检验。同学们通过实验得到的结论是甲同学的猜想不成立。
(2)二氧化硫有刺激性,闻此气体无味,乙同学猜想不正确。
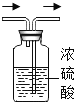
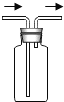
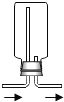
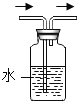
(3)同学们与丙同学一道设计了如下图所示的装置来验证丙同学的猜想:

[资料]无水硫酸铜遇水变蓝色。
①A装置中的试剂是_____,它的作用是_____。
②通入产生的气体前,应先检查气体的纯度,且实验中也要先通入一会儿气体,排尽装置内的空气,然后再给氧化铜加热。其目的都是为了防止_____。
③同学们通过实验确认丙同学的猜想是正确的。则在实验过程中,除观察到C装置中无水硫酸铜变成蓝色外,还观察到B装置的硬质玻璃管内的现象是_____,产生此现象的化学方程式是_____。
【答案】带火星的木条 浓硫酸 干燥 爆炸 黑色固体变红色 ![]()
【解析】
铁和硫酸铜反应生成铜和硫酸亚铁,氢气和氧化铜反应生成铜和水。
[实验设计](1)氧能使带火星的木条复燃,故验证甲同学的猜想,应用带火星的木条来检验。
①A装置中的试剂是浓硫酸,它的作用是干燥。
②通入产生的气体前,应先检查气体的纯度,且实验中也要先通入一会儿气体,排尽装置内的空气,然后再给氧化铜加热。其目的都是为了防止爆炸。
③氢气和氧化铜反应生成铜和水,则在实验过程中,除观察到C装置中无水硫酸铜变成蓝色外,还观察到B装置的硬质玻璃管内的现象是黑色固体变红色,产生此现象的化学方程式是![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】已知废旧干电池填料中含有二氧化锰、氯化铵和氯化锌等,某化学兴趣小组想回收利用废旧干电池中的二氧化锰和氯化铵,设计了如下流程:

(1)操作1和操作2的名称都是_____,该操作中用到的玻璃仪器除漏斗、烧杯外,还需要_____,其作用是_____。
(2)灼烧滤渣l时,会产生一种使澄清石灰水变浑浊的气体,由此推测滤渣1中除含有MnO2外,还存在的物质是_____。
(3)己知滤液1中氯化铵和氯化锌的浓度相近.在某温度下蒸发滤液1时,大量的氯化铵晶体先析出,说明该温度下氯化铵溶解度_____氯化锌的溶解度(填“<”、“=”或“>”)。
(4)同学们还设计了下列实验探究滤液2中的溶质成分。
(猜想)猜想一:氯化锌 猜想二:_____ 猜想三:氯化锌和氯化铵
(查阅资料)在氯化锌溶液中逐滴滴入稀氨水,先会生成白色沉淀,继续滴加白色沉淀会溶解。
(实验探究)
实验步骤 | 实验现象 | 实验结论 |
取少量滤液2,加入到过量氢氧化钠溶液中,并加热 | _____ | 滤液2中含有氯化铵 |
另取少量滤液2,_____ | _____ | 滤液2中含有氯化锌 |
(结论)猜想三成立。
【题目】钠是一种活泼金属,常温下能与氧气、水等物质发生反应。钠与水反应的化学方程式为:2Na+2H2O==2NaOH+H2↑。在实验室,小亮先取定量的硫酸铜溶液于烧杯中,再取一小块钠投入硫酸铜溶液中,充分反应后过滤,得到滤液和蓝色滤渣,并对滤被的成分进行探究。
(提出问题)滤液中溶质的成分是什么?
(查阅资料)Na2SO4溶液呈中性
(猜想与假设)猜想一:Na2SO4
猜想二:Na2SO4和NaOH
猜想三:____________
猜想四:Na2SO4、CuSO4和NaOH
小明认为猜想______不合理,理由是_______(用化学方程式表示)。
(实验与验证)
实验 | 实验操作 | 实验現象 | 实验结论 |
实验一 | 取少量滤液于试管中,仔细观察现象 | 溶液为无色 | 猜想_____不成立 |
实验二 | 向实验一所取滤液中滴入酚酞溶液 | ________ | 猜想二不成立 |
实验三 | 常温下,再取少量滤液,测溶液酸碱度 | pH=7 | 猜想_____成立 |
(拓展延伸)金属活动性顺序表中钠及前面的金属____(填“能”或“不能”)把位于后面的金属从它们盐溶液里置换出来。