题目内容
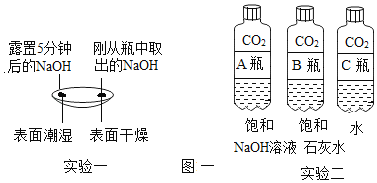
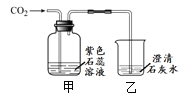
【题目】某化学兴趣小组的同学学习“灭火器原理”后,设计了如下图所示实验,并对反应后瓶中残留废液进行探究。
(提出问题)废液中所含溶质是什么?
(猜想与假设)
猜想1:废液中的溶质是NaCl、Na2CO3和HCl
猜想2:废液中的溶质只有NaCl
猜想3:皮液中的溶质是NaCl、HCl
猜想4:废液中的溶质是_____。
(讨论与交流)
小明认为猜想I无需验证就知道是错误的,用化学方程式说明他的理由_____
(实验与结论)
小亮同学为验证猜想3,取少量废液装入试管中,然后滴入酚酞溶液,发现溶液不变色,于是小亮认为猜想3正确。你认为他的结论正确或错误的理由是_____。
请你另设计实验方案验证猜想3:
实验步骤 | 实验现象 | 实验结论 |
_____ | _____ | 猜想3正确 |
(拓展与应用)若废液中的溶质是NaCl和HCl,根据盐酸的性质,无需另加试剂,只要对废液进行_____操作,即可从废液中得到NaCl固体。
【答案】NaCl、Na2CO3 Na2CO3+2HCl=2NaCl+H2O+CO2↑ 错误;只含氯化钠的溶液也不能使酚酞试液变色 取少量废液于试管中,加入适量碳酸钠溶液 产生气泡 蒸发
【解析】
[猜想与假设]
浓盐酸与浓碳酸钠反应生成氯化钠和水和二氧化碳,若恰好完全反应则所得溶液中溶质只有氯化钠;若盐酸过量则所得溶液中溶质为氯化钠和盐酸;若碳酸钠过量则所得溶液中溶质为氯化钠和碳酸钠
所以猜想中还缺碳酸钠过量的情况,所以猜想4的废液中溶质是氯化钠和碳酸钠,故填:NaCl、Na2CO3;
[讨论与交流]
猜想I无需验证就知道是错误的,因为碳酸钠与盐酸不能共存,所以相应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑,故填:Na2CO3+2HCl=2NaCl+H2O+CO2↑;
[实验与结论]
他的结论错误,因为酚酞只有遇到碱性溶液才会变成红色,在只有氯化钠的溶液中也不变色,所以不能说明溶液中含有氯化钠和盐酸。故填:错误;只含氯化钠的溶液也不能使酚酞试液变色。
实验方案:
操作步骤:取少量废液于试管中,加入适量碳酸钠溶液;现象:产生气泡;猜想3正确。故填:取少量废液于试管中,加入适量碳酸钠溶液 产生气泡
[拓展与应用]若废液中的溶质是NaCl和HCl,根据盐酸易挥发的性质,无需另加试剂,只要对废液进行蒸发操作,即可从废液中得到NaCl固体。故填:蒸发。